Grup ve Periyot Belirleme:
Periyodik sistemde, elementlerin dış katman elektron dizilimleri onların grup numarasını belirler. Baş gruplar için aşağıdaki gibi belirlenir.
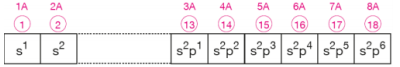
2He: 1s2 ile sonlanmasına rağmen soy gaz olduğu için 8A grubunda bulunurPeriyodik sistemde elementlerin temel hal elektron dağılımında yer alan en yüksek baş kuantum sayısı periyot numarasını belirler. Elektron dizilimleri s ile sonlanan elementler 1. ve 2. grupta (1A - 2A), p ile sonlananlar 13. grup ile 18. grup arasında (3A ile 8A), d ile sonlananlar ise 3. grup ile 12. grup arasında (3B ile 2B arasında) yer alırlar.
Bir elementin elektron düzeni d ile bitiyorsa bu element B grubu elementidir. B grubunun yerini belirtirken d den önce gelen s in enerji seviyesi periyodu s ve d de yer alan elektronların toplamı da grubu belirtir. Periyodik cetvelde 8 tane B grubu bulunur. Ancak ns ve (n–1)d orbitallerindeki toplam elektron sayısı 8, 9 ve 10 olanlar 8B, 11 olanlar 1B, 12 olanlar 2B grubunda yer alır.
B grupları ilk üç periyotta bulunmaz. 4. periyotla başlar, 2A ve 3A grupları arasında yer alır. Bir elementin periyodik sistemdeki yeri, nötr ve temel hali için bulunur. Uyarılmış bir atomun ya da bir iyonun yeri değerlendirilmez.
ATOM BÜYÜKLÜKLERİ VE ATOM YARIÇAPI
Metalik Yarıçap:
Metal kristalindeki iki metal atomunun çekirdekleri arasındaki uzaklığın yarısı metalik yarıçap olarak adlandırılır.
Kovalent Yarıçap:
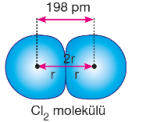
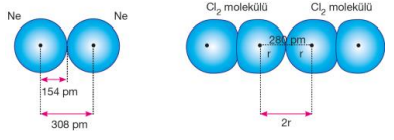
Kovalent bağlı iki atomun çekirdekleri arasındaki uzaklığın yarısına kovalent yarıçap denir. Moleküllerin bazıları aynı iki atomdan oluşurken aralarında tekli, ikili, üçlü şekillerde bağ yapabilirler. Her birinde atom yarıçapı farklı değerde olmakla birlikte, tekli bağ yapan aynı atomlu molekülde yarıçap, iki atomun çekirdekleri arasındaki uzaklığın yarısıdır. Ametal atomları arasında girişim olacağı unutulmamalıdır.
Van der Waals Yarıçapı :
Birbirleriyle etkileşim halinde olan aynı cins moleküllerdeki atomların veya soy gazlar gibi atomik yapıda bulunan maddelerdeki atomların birbirlerine en yakın olduğu andaki çekirdekleri arasındaki uzaklığın yarısıdır.
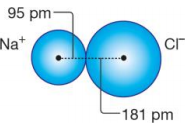
İyon Yarıçapı:
İyonik bağlı bileşiklerdeki iyonların çekirdekleri arasındaki uzaklıktan faydalanılarak hesaplanır. İyonlar aynı büyüklükte olmadığından iyon yarıçapı iyonların çekirdekleri arasındaki uzaklığın yarısına eşit değildir. Uzaklık anyon ve katyonun büyüklüğüne göre paylaştırılarak iyon yarıçapı bulunur.
Periyodik Tabloda Atom Yarıçaplarının Değişimi
Bir periyot içinde soldan sağa gidildikçe temel enerji düzeyi aynı kalırken çekirdek yükü birer birer artar. Bu durum çekirdeğin elektronları çekme gücünü arttırır. Dolayısıyla atom yarıçapı genellikle azalır. Yani temel enerji düzeyi sayısı eşit olan atomlardan proton sayısı büyük olanın yarıçapı genellikle daha küçüktür.
Örneğin, 6C: 1s22s22p2 9F: 1s22s22p5 C ve F' nin temel enerji düzeyi sayısı 2'dir. F' nin proton sayısı C' ninkinden daha büyük olduğu için atom yarıçapı daha küçüktür. Yarıçapları; C>F' dir.
Bir grup içinde yukarıdan aşağı doğru inildikçe en dış elektronun bulunduğu temel enerji düzeyi çekirdekten uzaklaşır. Bu da çekirdeğin çekim gücünü zayıflatır. Dolayısıyla atom yarıçapı artar. Örneğin, 4Be: 1s22s2 12Mg: 1s22s22p63s2 Be ve Mg aynı gruptadır. Mg'nin çekirdek çevresindeki yörünge sayısı daha fazla olduğundan çapı daha büyük olur. Yarıçapları; Mg > Be'dir.
Periyotta sağdan sola doğru gidildikçe genellikle atomların yarıçapları büyür.
Aynı grupta yukarıdan aşağı doğru inildikçe atomların yarıçapları büyür.
Bir atom ya da iyon elektron verdikçe elektron başına düşen çekirdek çekim kuvveti arttığından çapı küçülür. Örneğin, 13Al ile 13Al+3 atom ve iyonlarının çapları arasındaki ilişki, 13Al: 1s22s22p63s23p1 13Al3+ : 1s22s22p6 13Al atomu 3 katmanlı 13Al3+ iyonu 2 katmanlıdır. Katmanı az olan taneciğin çapı daha küçüktür. Çapları: Al > Al3+ dır.
Bir atom ya da iyon elektron aldıkça elektron başına düşen çekirdek çekim kuvveti azalacağından yarıçapı büyür. Örneğin, 8O ile 8O2– atom ve iyonlarının çapları arasındaki ilişki; 8O: 1s22s22p4 8O2- : 1s22s22p6 2– yüklü iyon oluşurken proton sayısı değişmeden elektron sayısı arttığından elektron başına düşen çekirdek çekim kuvveti azalır. Çapları: O2– > O'dur.
İzoelektronik katyonlar arasında iyon yükü arttıkça iyon yarıçapı küçülür. Çünkü elektron sayıları aynı iken katyonlardan proton sayısı dahaà fazla olan elektronları daha güçlü çeker. Örneğin, 11Na+ , 12Mg2+ ve 13Al3+ iyonlarının yarıçapları arasındaki ilişki;
11Na+>12Mg2+>13Al3+ şeklinde olur.
İzoelektronik anyonlar arasında iyon yükü arttıkça iyon yarıçapı küçülür. Çünkü elektron sayıları aynı iken anyonlardan proton sayısı daha fazlaà olan elektronları daha güçlü çeker. Örneğin, 15P3- , 16S2- ve 17Cl- iyonlarının çapları arasındaki ilişki;
15P3- > 16S2- > 17Cl- şeklinde olur.
İyonlaşma Enerjisi:
Gaz halindeki atomdan bir elektron kopartmak için verilmesi gereken minimum enerjiye iyonlaşma enerjisi adı verilir. İyonlaşma enerjisinin büyüklüğü atomdaki elektronların ne kadar sıkı tutulduğunun da bir ölçüsüdür. İyonlaşma enerjisi büyük olan atomlardan elektron koparmak daha zordur. Çok elektronlu bir atomda, atomun temel halinden ilk elektronu uzaklaştırmak için gerekli olan enerjinin miktarına birinci iyonlaşma enerjisi (E1) denir.
İkinci bir elektronu koparmak için gerekli enerjiye ikinci iyonlaşma enerjisi denir. İkinci iyonlaşma enerjisi (E2) ve üçüncü iyonlaşma enerjisi (E3) ise aşağıdaki eşitlikte verilmiştir.
E2 + X+ (g) → X2+ (g) + e- ikinci iyonlaşma
E3 + X2+ (g) → X3+ (g) + e- üçüncü iyonlaşma
Bir atomun elektron sayısı kadar iyonlaşma enerjisi değeri ölçülebilir. Bir atomdan bir elektron uzaklaştığı zaman, kalan elektronlar arasında itme kuvveti azalır. Çekirdek yükü sabit kaldığından, pozitif yüklü iyondan başka bir elektronu uzaklaştırmak için daha fazla enerji gerekir. Yani bir atomun her zaman ilk iyonlaşma enerjisi en düşüktür. Bu nedenle, iyonlaşma enerjisi aşağıdaki sırayla değişir. E1 < E2 < E3 < ………
Bazı düzensizlikler olmasına karşılık periyodik çizelgede birinci iyonlaşma enerjileri soldan sağa doğru artmaktadır. İlk istisna aynı periyottaki 2A ve 3A grupları arasında görülür. 3A grubu elementlerinin birinci iyonlaşma enerjileri beklenenin aksine 2A grubu elementlerininkinden daha düşüktür. Bunun nedeni 2A grubunun katman elektron dağılımının kararlılığa sahip olmasıdır. Aynı durum 5A ve 6A gruplarında da görülmektedir. Bir periyottaki iyonlaşma enerjisi aşağıdaki gibi değişmektedir.
1A < 3A < 2A < 4A < 6A < 5A < 7A < 8A
Periyodik tabloda aynı grupta yukarıdan aşağıya doğru yarıçap büyür. Bu da, değerlik elektronlarının çekirdekten uzaklaşması, onların çekirdek tarafından diğer elektronlara oranla daha zayıf çekilmesi anlamına gelmektedir. Bu nedenle, bir grupta yukarıdan aşağıya doğru gidildikçe çap büyümekte, bununla birlikte iyonlaşma enerjisi ise küçülmektedir. Endotermik bir olaydır. İyonlaşma enerjisi, atom çapı ile ters orantılıdır.
Elektron İlgisi (Eİ):
Gaz halindeki bir atomun bir elektron alması sırasında oluşan ısı değişimine elektron ilgisi denir. Elektron ilgisi pozitif veya negatif olabilir.
Elektron ilgisinin büyük negatif değer olması elektron alma işlemi sonucunda büyük enerjiler açığa çıktığını ve bu atomun elektron almaya elverişli olduğunun göstergesidir. Eksi işareti değerin azaldığının göstergesi değildir. Bu nedenle elektron almaya en yatkın olan halojenlerin (7A grubu) elektron ilgileri en yüksektir.
Aynı periyotta soldan sağa doğru gidildikçe elektron ilgisi artar.Aynı grupta yukarı doğru gidildikçe elektron ilgisi genellikle artar. (İstisna: klorun elektron ilgisi florunkinden büyüktür.)Ametallerin elektron ilgileri metallerden fazladır. Soy gazların ise elektron ilgileri çok küçük olduğundan yok kabul edilir.
Elektron ilgisi bir elementin elektron alma eğiliminin ölçüsüdür.Bir atom elektron aldığında açığa çıkarı ısı ne kadar fazla ise elektron ilgisi o kadar yüksektir.Periyodik tabloda aşağıdan yukarıya ve soldan sağa doğru elektron ilgisi genellikle artar. 8A grubunun elektron ilgisi yoktur. Dolayısıyla aynı periyotta 7A grubunun elektron ilgisi en fazladır.
Elektronegatiflik (En):
Kimyasal bağ oluşturmuş bir atomun bağ elektronları üzerindeki çekme gücünün ölçüsüdür. Elektronegatiflik doğrudan ölçülemediği gibi birimide yoktur.Elektronegatiflik atomların iyonlaşma enerjisi ve elektron ilgisi ile ilgili bir değerdir. Bu değerler kullanılarak elektronegatiflik hesaplanabilir.
Elektronegatifliği en yüksek olan element flordur. Florun elektronegatiflik değeri 4 kabul edilmiştir. Diğer elementlerin elektronegatifliği flor atomunun elektronegatifliğine (4,0) kıyasla hesaplanmıştır. Periyodik tabloda genel eğilim elektronegatifliğin soldan sağa ve aşağıdan yukarıya doğru artması yönündedir. 8A gruplarının elektronegatifliği yoktur. Metallerin elektronegatiflikleri 1,7 değerinden aşağıda, ametallerin ise 2,0 değerinden yukarıdadır. Bu iki değer arasında yer alan elementler yarı metaldir.
Ametaller metallere göre yüksek elektronegatiflik değerine sahiptirler. İyonlaşma enerjisi ve elektron ilgisi arttığı için atomların Aynı grupta aşağıdanàelektronegatiflik değerleri de artar. Periyodik tabloda elementlerin elektronegatifliklerinin değişimi şu şekildedir; yukarıya doğru gidildikçe genellikle elektronegatiflik artar.
Aynı periyotta soldan sağa doğru gidildikçe genellikle elektronegatiflik artar.
Elektronegatiflik, elektron ilgisi ile ilgilidir, ancak aynısı değildir. Florun elektronegatifliği en büyük iken, klorun elektron ilgisi en büyüktür.