
Periyodik Tabloda Atom Yarıçaplarının Değişimi Bir periyot içinde soldan sağa gidildikçe temel enerji düzeyi aynı kalırken çekirdek yükü birer birer artar. Bu durum çekirdeğin elektronları çekme gücünü arttırır. Dolayısıyla atom yarıçapı genellikle azalır. Yani temel enerji düzeyi sayısı eşit olan atomlardan proton sayısı büyük olanın yarıçapı genellikle daha küçüktür.

Periyotta sağdan sola doğru gidildikçe genellikle atomların yarıçapları büyür. Aynı grupta yukarıdan aşağı doğru inildikçe atomların yarıçapları büyür. Bir atom ya da iyon elektron verdikçe elektron başına düşen çekirdek çekim kuvveti arttığından çapı küçülür.

2– yüklü iyon oluşurken proton sayısı değişmeden elektron sayısı arttığından elektron başına düşen çekirdek çekim kuvveti azalır. Çapları: O2– > O'dur. İzoelektronik katyonlar arasında iyon yükü arttıkça iyon yarıçapı küçülür. Çünkü elektron sayıları aynı iken katyonlardan proton sayısı daha fazla olan elektronları daha güçlü çeker.

İzoelektronik anyonlar arasında iyon yükü arttıkça iyon yarıçapı küçülür. Çünkü elektron sayıları aynı iken anyonlardan proton sayısı daha fazlaà olan elektronları daha güçlü çeker.
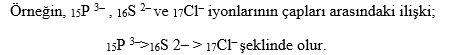
İyonlaşma Enerjisi: Gaz halindeki atomdan bir elektron kopartmak için verilmesi gereken minimum enerjiye iyonlaşma enerjisi adı verilir. İyonlaşma enerjisinin büyüklüğü atomdaki elektronların ne kadar sıkı tutulduğunun da bir ölçüsüdür. İyonlaşma enerjisi büyük olan atomlardan elektron koparmak daha zordur. Çok elektronlu bir atomda, atomun temel halinden ilk elektronu uzaklaştırmak için gerekli olan enerjinin miktarına birinci iyonlaşma enerjisi (E1) denir. İkinci bir elektronu koparmak için gerekli enerjiye ikinci iyonlaşma enerjisi denir. İkinci iyonlaşma enerjisi (E2) ve üçüncü iyonlaşma enerjisi (E3) ise aşağıdaki eşitlikte verilmiştir.
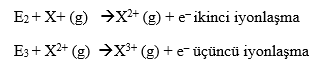
Bir atomun elektron sayısı kadar iyonlaşma enerjisi değeri ölçülebilir. Bir atomdan bir elektron uzaklaştığı zaman, kalan elektronlar arasında itme kuvveti azalır. Çekirdek yükü sabit kaldığından, pozitif yüklü iyondan başka bir elektronu uzaklaştırmak için daha fazla enerji gerekir. Yani bir atomun her zaman ilk iyonlaşma enerjisi en düşüktür. Bu nedenle, iyonlaşma enerjisi aşağıdaki sırayla değişir. E1 < E2 < E3 < ………
Bazı düzensizlikler olmasına karşılık periyodik çizelgede birinci iyonlaşma enerjileri soldan sağa doğru artmaktadır. İlk istisna aynı periyottaki 2A ve 3A grupları arasında görülür. 3A grubu elementlerinin birinci iyonlaşma enerjileri beklenenin aksine 2A grubu elementlerininkinden daha düşüktür. Bunun nedeni 2A grubunun katman elektron dağılımının kararlılığa sahip olmasıdır. Aynı durum 5A ve 6A gruplarında da görülmektedir. Bir periyottaki iyonlaşma enerjisi aşağıdaki gibi değişmektedir.
1A < 3A < 2A < 4A < 6A < 5A < 7A < 8A
Periyodik tabloda aynı grupta yukarıdan aşağıya doğru yarıçap büyür. Bu da, değerlik elektronlarının çekirdekten uzaklaşması, onların çekirdek tarafından diğer elektronlara oranla daha zayıf çekilmesi anlamına gelmektedir. Bu nedenle, bir grupta yukarıdan aşağıya doğru gidildikçe çap büyümekte, bununla birlikte iyonlaşma enerjisi ise küçülmektedir. Endotermik bir olaydır. İyonlaşma enerjisi, atom çapı ile ters orantılıdır.
Elektron İlgisi (Eİ): Gaz halindeki bir atomun bir elektron alması sırasında oluşan ısı değişimine elektron ilgisi denir. Elektron ilgisi pozitif veya negatif olabilir. Elektron ilgisinin büyük negatif değer olması elektron alma işlemi sonucunda büyük enerjiler açığa çıktığını ve bu atomun elektron almaya elverişli olduğunun göstergesidir. Eksi işareti değerin azaldığının göstergesi değildir. Bu nedenle elektron almaya en yatkın olan halojenlerin (7A grubu) elektron ilgileri en yüksektir. Aynı periyotta soldan sağa doğru gidildikçe elektron ilgisi artar. Aynı grupta yukarı doğru gidildikçe elektron ilgisi genellikle artar. (İstisna: klorun elektron ilgisi florunkinden büyüktür.) Ametallerin elektron ilgileri metallerden fazladır. Soy gazların ise elektron ilgileri çok küçük olduğundan yok kabul edilir. Elektron ilgisi bir elementin elektron alma eğiliminin ölçüsüdür. Bir atom elektron aldığında açığa çıkarı ısı ne kadar fazla ise elektron ilgisi o kadar yüksektir. Periyodik tabloda aşağıdan yukarıya ve soldan sağa doğru elektron ilgisi genellikle artar. 8A grubunun elektron ilgisi yoktur. Dolayısıyla aynı periyotta 7A grubunun elektron ilgisi en fazladır.
Elektronegatiflik (En): Kimyasal bağ oluşturmuş bir atomun bağ elektronları üzerindeki çekme gücünün ölçüsüdür. Elektronegatiflik doğrudan ölçülemediği gibi birimi de yoktur. Elektronegatiflik atomların iyonlaşma enerjisi ve elektron ilgisi ile ilgili bir değerdir. Bu değerler kullanılarak elektronegatiflik hesaplanabilir. Elektronegatifliği en yüksek olan element flordur. Florun elektronegatiflik değeri 4 kabul edilmiştir. Diğer elementlerin elektronegatifliği flor atomunun elektronegatifliğine (4,0) kıyasla hesaplanmıştır. Periyodik tabloda genel eğilim elektronegatifliğin soldan sağa ve aşağıdan yukarıya doğru artması yönündedir. 8A gruplarının elektronegatifliği yoktur. Metallerin elektronegatiflikleri 1,7 değerinden aşağıda, ametallerin ise 2,0 değerinden yukarıdadır. Bu iki değer arasında yer alan elementler yarı metaldir. Ametaller metallere göre yüksek elektronegatiflik değerine sahiptirler. İyonlaşma enerjisi ve elektron ilgisi arttığı için atomların aynı grupta aşağıdan elektronegatiflik değerleri de artar. Periyodik tabloda elementlerin elektronegatifliklerinin değişimi şu şekildedir; yukarıya doğru gidildikçe genellikle elektronegatiflik artar. Aynı periyotta soldan sağa doğru gidildikçe genellikle elektronegatiflik artar. Elektronegatiflik, elektron ilgisi ile ilgilidir, ancak aynısı değildir. Florun elektronegatifliği en büyük iken, klorun elektron ilgisi en büyüktür.

METAL VE AMETAL ÖZELLİKLERİN DEĞİŞİMİ Elementleri elektron dizilişlerine göre metal, ametal ve yarı metal olarak sınıflandırabiliriz.

ASİTLİK VE BAZLIK ÖZELLİKLERİNİN DEĞİŞİMİ Elementlerin asitlik ve bazlık özellikleri genellikle oksitleri ve hidroksitleri üzerinden incelenebilir.

Oksitlerin asidik ve bazik özelliği bileşik oluşturduğu elementin elektronegatifliğine bağlıdır. Elektronegatifliği düşük olan elementlerin oksitleri ve hidroksitleri bazik, elektronegatifliği yüksek olan elementlerin oksitleri ve hidroksitleri asidik özellik gösterir. Genel olarak metallerin elektronegatiflikleri küçük olduğu için metal oksitleri sulu çözeltisinde bazik özellik gösterir. Genel olarak ametallerin elektronegatiflikleri büyük olduğu için oksijence zengin olan ametal oksitleri suda çözündüğünde asit özellik gösterir (CO2, SO2, SO3...). Bir periyotta sağa doğru gidildikçe elementlerin oksijenli bileşiklerinin asitlik özelliği artarken, sola doğru gidildikçe bazlık özelliği artar. Hem asit hem de baz özelliği gösteren maddelere amfoter madde (Al, Zn, Cr...), oksitlere ise amfoter oksit denir (Al2O3, ZnO...)