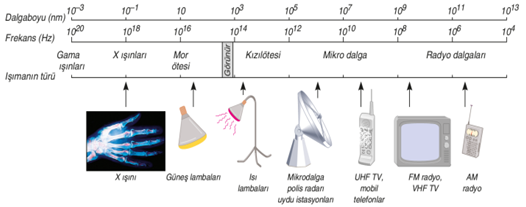
1893-Wilhelm Wien → Siyah Cisim Işıması
Üzerine gelen bütün ışınları soğuran maddelere siyah cisim denir. Siyah cisimler farklı sıcaklıklarda farklı renkte ışımalar yaparlar. Bu dalga boyuyla ilişkilidir ve klasik fizik bunu açıklayamıyordu. Daha sonra plank kuantum fikrini ortaya atarak dalga kuramındaki bir eksiği gidermiştir.
1897-Thomson Atom Modeli

Maddenin yapısında proton ve elektronların varlığının kanıtlanması, proton kütlesinin elektron kütlesinden çok büyük olması, J.J. Thomson'ın Dalton atom modelinden daha gelişmiş bir model ortaya atmasına neden oldu.
Thomson'a göre; Atom küre şeklindedir ve yaklaşık çapı 10–10 metredir.
(+) yüklerin (proton) ve (–) yüklerin (elektron) atomda homojen dağıldığı iddiası yanlıştır. Ayrıca bu modelde nötrondan ve atom çekirdeğinden bahsedilmemesi modelin eksik bir tarafıdır.
1900-Planck Kuantum Teorisi
Değişik sıcaklıklarda katıların yayıldığı ışınları incelemiştir.
Atom ve moleküllerin enerji paketçikleri adı verilen belli miktardaki enerjiyi yaydıklarını keşfetmiştir. Elektromanyetik radyasyon şeklinde yayılan veya emilen en küçük enerji miktarını kuantum olarak adlandırmıştır. Buna fotonda denir.
Tek bir enerji kuantumunun yaydığı enerji (E), radyasyonun frekansı(v) ile doğru orantılıdır. Bu orantının sabiti h ile gösterilir.
Plank sabiti olarak adlandırılır. E=h.v plank sabitinin değeri: 6,64. 10−34 j.s dir. Frekans v=c/ λ olduğu için eşitlik E=h.𝑐 λ şeklinde yazılabilir.
1905-Albert Einstein → Foto elektrik olay
• Albert Einstein, Planck’ın kuantum teorisini fotoelektirik etkiyi açıklamak için kullanmıştır.
• Metal yüzeyine ışık düşürüldüğünde metal yüzeyinden elektron çıkmasıyla fotoelektirik olay denir. Elektron çıkması gelen ışının frekansına bağlıdır. Belli frekansın altındaki ışınlar elektron çıkaramazlar.
1908-Millikan → Yağ damlası deneyi-Elektronun yük ve kütlesinin bulunuşu
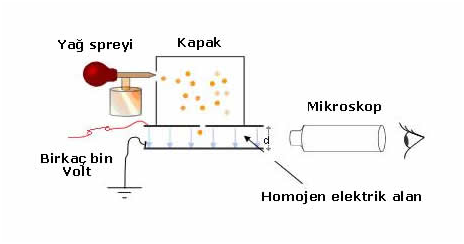
Millikan yağ damlası deneyi ile elektronların yükünü hesaplamış ve thomson tarafından hesaplanan e/m oranında elektronun yükünü eşitlikte yerine koyarak elektronun kütlesini bulmuştur.
Millikan deneyde yüklü levhalar arasına püsküren yağ damlacıkları üzerine x ışınları göndererek yağ damlacıklarının yüklü olmasını sağlamıştır. Yağ damlacıkları üzerindeki yükü 1,60.10-19 C ve katları olarak hesaplamıştır.
e/m=– 1,76. 108 c/g eşitliğinden → −1,60.10-19 C /m = – 1,76. 108 c/g yazılabilir. Buradan m = 9,1.10-28 gr olarak bulunur. Tüp içersine H2 gazı konulduğunda yük/kütle oranı: 9.5791.104 coul/g pozitif yüklü taneciklerin oluştuğu görülüyordu.
Elektronunu kaybetmiş olan bu en küçük hidrojen taneciğine proton adı verildi. Protonun yükü elektronun yükü ile eşit ama zıt işaretlidir. Yük yerine, pozitif elektronun yükü konulduğunda; Buna göre, protonun kütlesi ise, bir elektronun kütlesinin yaklaşık 1840 olduğu görülmüş oldu.
1910-Rutherford Atom Teorisi
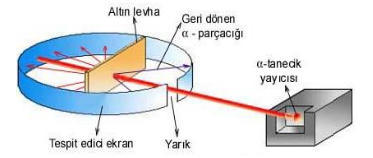
Thomson atom modelinden yararlandı. L. Rutherfordun deney düzeneğinde, Radyoaktif alfa (a) ışın kaynağı Polonyum (Po) elementinden gelen ışınlar kurşun levhadan geçip ince altın levhaya düşürüldüğünde ışınların çok büyük bir kısmının geçtiği çok az bir kısmının geri döndüğü gözlenmiştir.
İnce altın yaprağa gelen α taneciklerin büyük kısmı sapmaya uğramadan geçer.
Bazı a tanecikleri çok az sapmaya uğrar. Birkaç tanesi yaprağı geçemez ve tam geri döner.
Birkaç tanesi büyük oranda sapmaya uğrar. Bunun sonucunda Rutherford, Bir atomun kütlesinin çok büyük bir kısmı ve pozitif yükün tümü çekirdek adı verilen çok küçük bir bölgede toplanmıştır. Bunlara proton denir.
Çekirdekteki proton sayısı atomdan atoma değişir ve sayısı, elementin kütle numarasının yaklaşık yarısına eşittir.
Çekirdek dışında proton sayısına eşit sayıda elektron bulunur.
Günümüzdeki atom modeline yaklaşarak ilk defa çekirdek fikrini ortaya atmıştır. Elektronların neden çekirdeğe yapışmadığını açıklayamamıştır