PERİYODİK SİSTEM VE PERİYODİK ÖZELLİKLERİN DEĞİŞİMİ
Periyodik sistem, elementlerin fiziksel ve kimyasal özelliklerinin bir fonksiyonu olarak ortaya çıkmıştır. Elementler atom numaralarına göre sıralandığında elementlerin belli aralıklarla (periyodik olarak) bazı kimyasal özelliklerinin tekrarlandığı görülmüştür. Bu nedenle benzer özellikleri gösteren elementler alt alta yazılmıştır. Böylece yatay sıralar ve düşey sütunlardan oluşan periyodik sistem elde edilmiştir. Periyodik sistemdeki yatay sıralara periyot denir. Toplam 7 tane periyot vardır. Aynı periyottaki elementlerin baş kuantum sayıları aynıdır.
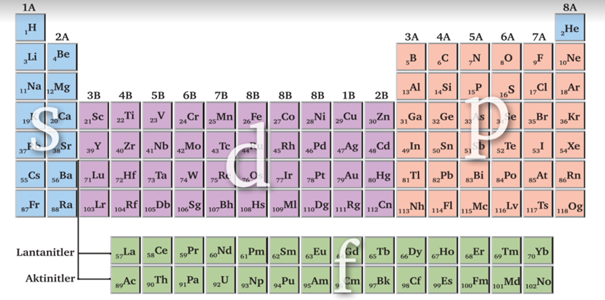

Periyodik sistemdeki düşey sütunlara grup adı verilir. Aynı gruptaki element atomlarının (He hariç) elektron katmanlarındaki elektron dizilimleri benzer olduğundan aynı gruptaki elementler benzer kimyasal özellikler gösterirler. Gruplar A ve B olarak ya da 1 - 18 arası rakamlar verilerek düzenlenmiştir. 18 adet düşey sütun vardır. Bunlardan 8 tanesi A grubu, 10 tanesi B grubu sütunudur. A grubu elementlerine ana (baş) grup elementleri adı verilir. B grubu elementleri ise yan grup elementleri olarak adlandırılır. Bazı gruplara ise elementlerin kimyasal özellikleri dikkate alınarak özel isimler verilmiştir.
1A grubu; Alkali metaller (H hariç)
2A grubu; Toprak alkali metaller
3A grubu; Toprak metaller 7A grubu; Halojenler
8A grubu; Soy gazlar
B grupları; Geçiş metalleri
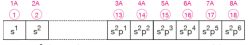
Gruplar içerdikleri elementlerin elektron dağılımlarındaki en son orbitalinin türüne göre s, p, d, f bloklarına ayrılır. 1A ve 2A grupları s bloğunu; 3A, 4A, 5A, 6A, 7A ve 8A grupları p bloğunu oluşturur. s ve p blok elementleri ana grup elementleridir.
B grupları d ve f bloğunu oluşturur. d bloğu elementleri geçiş metali olarak adlandırılır. f bloğu elementleri lantanitler ve aktinitler den oluşur.
Grup ve Periyot Belirleme: Periyodik sistemde, elementlerin dış katman elektron dizilimleri onların grup numarasını belirler. Baş gruplar için aşağıdaki gibi belirlenir.
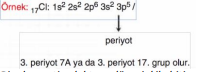
2He: 1s2 ile sonlanmasına rağmen soy gaz olduğu için 8A grubunda bulunur. Periyodik sistemde elementlerin temel hal elektron dağılımında yer alan en yüksek baş kuantum sayısı periyot numarasını belirler. Elektron dizilimleri s ile sonlanan elementler 1. ve 2. grupta (1A - 2A), p ile sonlananlar 13. grup ile 18. grup arasında (3A ile 8A), d ile sonlananlar ise 3. grup ile 12. grup arasında (3B ile 2B arasında) yer alırlar.
Bir elementin elektron düzeni d ile bitiyorsa bu element B grubu elementidir. B grubunun yerini belirtirken d den önce gelen s in enerji seviyesi periyodu s ve d de yer alan elektronların toplamı da grubu belirtir. Periyodik cetvelde 8 tane B grubu bulunur. Ancak ns ve (n–1)d orbitallerindeki toplam elektron sayısı 8, 9 ve 10 olanlar 8B, 11 olanlar 1B, 12 olanlar 2B grubunda yer alır. B grupları ilk üç periyotta bulunmaz. 4. periyotla başlar, 2A ve 3A grupları arasında yer alır. Bir elementin periyodik sistemdeki yeri, nötr ve temel hali için bulunur. Uyarılmış bir atomun ya da bir iyonun yeri değerlendirilmez.
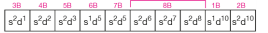

s BLOKU ELEMENTLERİ VE ÖZELLİKLERİ
Periyodik sistemde, en solda bulunan ilk iki sütundaki 1A ve 2A grubu elementleri s blokundadır. 8A grubunun ilk elementi olan helyum, elektron dizilişi (2He: 1s2) nedeniyle bazı periyodik sistemlerde s blokunda gösterilmektedir. Elementlerin elektron dizilişi s orbitaliyle sonlandığı için s orbitali yarı dolu ya da tam doludur, bu nedenle hepsi küresel simetrik yapıya sahiptir.

p BLOKU ELEMENTLERİ VE ÖZELLİKLERİ
Periyodik sistemde, en sağda bulunan son altı sütundaki elementlerin elektron dizilişi p orbitaliyle sonlandığı için elementler p blokunda yer alır . Bu elementlerin değerlik orbitalleri s ve pʼdir. Metal, ametal, yarı metal ve soygazlar bu blokta yer alır.

d BLOKU ELEMENTLERİ VE ÖZELLİKLERİ
d bloku periyodik sistemde s bloku ile p bloku (2A ve 3A grupları) arasında yer alır. 10 sütundan oluşan, elektron dizilişleri d orbitaliyle sonlanan elementleri içeren bloktur. Periyodik sistemde d bloku elementleri 4. periyottan başlayarak her periyotta bulunur. 3B grubu ile başlar ve 2B grubu ile biter. d blokunda toplam 10 sütun olmasına rağmen 8 tane B grubu bulunmasının nedeni 8B grubunun üç alt sütundan oluşmasıdır. d bloku elementlerinin sayısı diğer blok elementlerinin sayısından fazladır. d bloku elementleri geçiş elementleri veya geçiş metalleri olarak adlandırılır. Geçiş elementlerinin öz kütleleri genellikle fazladır ve çoğu, ağır metal olarak da sınıflandırılır.

f Bloku Elementleri ve Özellikleri f bloku elementlerine iç geçiş elementleri ya da iç geçiş metalleri denir. f bloku metallerinin 1. yatay sırasına lantanitler, 2. yatay sırasına aktinitler adı verilir. f blok elementleri ısı ve elektriği iyi iletir. f bloku elementlerinin erime ve kaynama noktaları yüksektir. Renkleri gümüşe benzer. Lantanit ve aktinitler genellikle yüksek atom yoğunluğuna sahip, iyonlaşma enerjileri oldukça düşük olan aktif elementlerdir. Kimyasal özellikleri birbirine benzeyen f bloku elementlerinin atom hacimleri birbirine yakındır ve bileşiklerinde genellikle +3 iyon yüküne sahiptir. Lantanitlerden prometyum (Pm) elementi ve tüm aktinitler radyoaktif özelliğe sahiptir.

ATOM BÜYÜKLÜKLERİ VE ATOM YARIÇAPI
Kuantum kuramı tek bir atoma ait büyüklükten söz etmez. Çünkü elektronlar çekirdeğe yakın bölgelerde bulunur. Çekirdekten uzaklaştıkça bulunma olasılıkları azalır. Ancak atomlar aralarında etkileşerek bağ yaptıklarında aralarındaki uzaklıklar hesaplanır. Bu uzaklıklar genellikle X ışınları kırınım yöntemi ile belirlenir. Atomlar küresel olduklarından büyüklükleri yarıçap olarak belirlenir ve bağ yaptıklarında yarıçaplar değişir.
Metalik Yarıçap: Metal kristalindeki iki metal atomunun çekirdekleri arasındaki uzaklığın yarısı metalik yarıçap olarak adlandırılır.
Kovalent Yarıçap: Kovalent bağlı iki atomun çekirdekleri arasındaki uzaklığın yarısına kovalent yarıçap denir. Moleküllerin bazıları aynı iki atomdan oluşurken aralarında tekli, ikili, üçlü şekillerde bağ yapabilirler. Her birinde atom yarıçapı farklı değerde olmakla birlikte, tekli bağ yapan aynı atomlu molekülde yarıçap, iki atomun çekirdekleri arasındaki uzaklığın yarısıdır. Ametal atomları arasında girişim olacağı unutulmamalıdır.
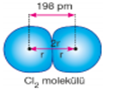
Van der Waals Yarıçapı: Birbirleriyle etkileşim halinde olan aynı cins moleküllerdeki atomların veya soy gazlar gibi atomik yapıda bulunan maddelerdeki atomların birbirlerine en yakın olduğu andaki çekirdekleri arasındaki uzaklığın yarısıdır.
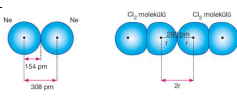
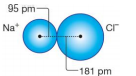
İyon Yarıçapı: İyonik bağlı bileşiklerdeki iyonların çekirdekleri arasındaki uzaklıktan faydalanılarak hesaplanır. İyonlar aynı büyüklükte olmadığından iyon yarıçapı iyonların çekirdekleri arasındaki uzaklığın yarısına eşit değildir. Uzaklık anyon ve katyonun büyüklüğüne göre paylaştırılarak iyon yarıçapı bulunur.