ORBİTALLERİN ENERJİLERİ
Elektron dizilimini yapabilmek için öncelikle orbitallerin enerjilerinin karşılaştırılması bilinmelidir. Hidrojen gibi tek elektronlu sistemlerde elektronun sahip olduğu enerji yalnızca baş kuantum sayısına (n) bağlıdır. Çok elektronlu atomlarda elektronların sahip olduğu enerjiler n değeri yanında l ile de ilişkilidir. Kletchkowski–Madelung İlkesi: Elektronlar (n + l ) değeri küçük olan orbitalden başlanarak yerleşir. Çünkü (n + l ) değeri arttıkça orbital enerjisi artar. (n + l ) değeri aynı ise n sayısı büyük olan orbitalin enerjisi yüksektir.
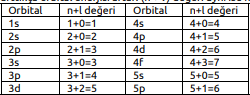
Buna göre orbitallerin enerji sıralaması aşağıdaki gibidir.
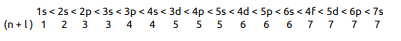

ATOMLARIN ELEKTRON DİZİLİŞLERİ
Aufbau İlkesi : Elektronlar orbitallere yerleşirken öncelikle enerjisi en düşük yani çekirdeğe en yakın orbitalleri doldururlar. Bu nedenle elektronlar 1s'den başlayarak enerjisi düzgün bir şekilde artacak şekilde sıralanırlar.
Pauli İlkesi: Bir atomdaki herhangi iki elektronun tüm kuantum sayıları (n, l, ml , ms) aynı olamaz. Bir orbitalde zıt spinli (elektronun dönme hareketi) en fazla iki elektron bulunabilir. Pauli ilkesine göre s, p, d, f orbitallerinde,
s orbitali: En fazla 2 elektron p orbitali: En fazla 6 elektron
d orbitali: En fazla 10 elektron f orbitali: En fazla 14 elektron
Hund Kural: Elektronlar eş enerjili orbitallere yerleşirken öncelikle her bir orbitale bir elektron yerleştirilir. Daha sonra ikinci elektronlar orbitallere ters spinli olacak şekilde yerleştirilir. Atomların elektron dizilimleri yazılırken orbital sembollerinin önüne, orbitalin bulunduğu temel enerji düzeyinin numarası (baş kuantum sayısı) yazılır. Orbital sembolünün sağ üstüne üst indis olarak içerdiği elektron sayısı yazılır. Atomların elektron dizilimleri yazılırken orbital sembollerinin önüne, orbitalin bulunduğu temel enerji düzeyinin numarası (baş kuantum sayısı) yazılır. Orbital sembolünün sağ üstüne üst indis olarak içerdiği elektron sayısı yazılır. Orbitallerin enerji sıralamaları, alabildikleri en fazla elektron sayıları ve bu elektronların orbitallere yerleşim sıralaması;
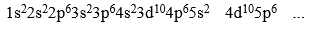
şeklindedir.
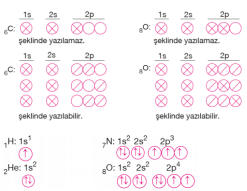
Bazı atomların elektron dağılımları ve orbital şemaları şu şekildedir. Atomların elektron dağılımları soy gazlardan faydalanılarak daha kısa şekilde gösterilebilir. Bunun için elementlerin elektron diziliminde en büyük atom numarasına sahip hangi soy gaz bulunuyorsa, o soy gazın sembolü yazılır ve devamında kalan elektronlar orbitallere yerleştirilir.
İyonların Elektron Dizilimi: İyonların elektron dizilimi, atomun aldığı ya da verdiği elektron sayıları göz önünde bulundurularak düzenlenir. Atomlar elektron aldıklarında, elektronlar boş veya yarı dolu orbitallere enerjisi en düşük orbitalden başlayarak yerleşirler.
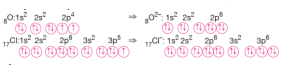
Atomlar elektron verdiklerinde elektron öncelikle en büyük temel enerji seviyesinden kopar.

Uyarılmış Hâl ve Temel Hâl: Elektronların en düşük enerjili kararlı haline temel hâl denir. Temel haldeki bir atoma dışarıdan enerji verildiğinde elektronlarından en az bir tanesinin daha yüksek enerji seviyesindeki bir orbitale ya da aynı yörüngede daha yüksek enerjili bir orbitale gitmesi durumuna uyarılmış atom adı verilir.
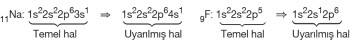
Uyarılmış atomların;
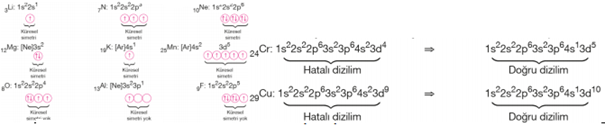
KÜRESEL SİMETRİ: Bir atomun elektron dizilimindeki en son orbital türünün tam dolu veya yarı dolu olması, atoma küresel simetri özelliği kazandırır. Küresel simetri gösteren atomlarda elektronlar çekirdek tarafından simetrik çekilirler. Bu durum atoma kararlılık sağlar ve elektronu koparmak daha fazla enerji gerektirir. Elektron dizilimleri s1, s2, p3, p6, d5, d10, f 7 ve f14 ile sonlanan atomlar küresel simetri özelliği gösterir. Bazı geçiş metali atomları küresel simetriye sahip olmak yani daha kararlı olmak için, elektron dizilimini ns2 (n – 1)d4 ile bitenler ns1 (n – 1)d5 şekline ns2 (n – 1)d9 ile bitenler ns1 (n – 1)d10 şekline dönüştürür. Örneğin Cr ve Cu atomlarında bu olay gerçekleşir. Bazı atomların elektron dizilimleri beklenenden farklı olarak daha kararlı yapıdaki küresel simetrik haldedir. Elektron dizilimi d4 ya da d9 ile sona ermesi gereken atomlar daha kararlı olabilmek için küresel simetrik hale gelirler. Bu nedenle elektron dizilimleri s2d 4 şeklinde olanlar s 1d 5 ve s2d 9 şeklinde olanlar s1d 10 şeklinde elektron dizilimine sahip olur. Küresel simetrik dağılım, çekirdek (protonlar) ile değerlik elektronları arasındaki çekim kuvvetinin güçlü olmasına, atomun enerjisinin azalmasına, atomun daha kararlı olmasına yol açar.