
1900-Planck Kuantum Teorisi: Değişik sıcaklıklarda katıların yayıldığı ışınları incelemiştir. Atom ve moleküllerin enerji paketçikleri adı verilen belli miktardaki enerjiyi yaydıklarını keşfetmiştir. Elektromanyetik radyasyon şeklinde yayılan veya emilen en küçük enerji miktarını kuantum olarak adlandırmıştır. Buna fotonda denir.
Tek bir enerji kuantumunun yaydığı enerji (E), radyasyonun frekansı(v) ile doğru orantılıdır. Bu orantının sabiti h ile gösterilir.


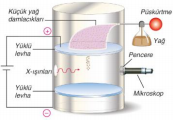
Millikan yağ damlası deneyi ile elektronların yükünü hesaplamış ve thomson tarafından hesaplanan e/m oranında elektronun yükünü eşitlikte yerine koyarak elektronun kütlesini bulmuştur. Millikan deneyde yüklü levhalar arasına püsküren yağ damlacıkları üzerine x ışınları göndererek yağ damlacıklarının yüklü olmasını sağlamıştır. Yağ damlacıkları üzerindeki yükü 1,60.10−19 C ve katları olarak hesaplamıştır. e/m=– 1,76. 108 c/g eşitliğinden à −1,60.10−19 C /???? = – 1,76. 108 c/g yazılabilir. Buradan m = 9,1.10 −28 gr olarak bulunur. Tüp içersine H2 gazı konulduğunda yük/kütle oranı: 9.5791.104 coul/g pozitif yüklü taneciklerin oluştuğu görülüyordu. Elektronunu kaybetmiş olan bu en küçük hidrojen taneciğine proton adı verildi. Protonun yükü elektronun yükü ile eşit ama zıt işaretlidir. Yük yerine, pozitif elektronun yükü konulduğunda; Buna göre, protonun kütlesi ise, bir elektronun kütlesinin yaklaşık 1840 olduğu görülmüş oldu.

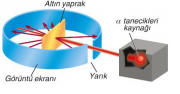
1910-Rutherford Atom Teorisi Thomson atom modelinden yararlandı. L. Rutherfordun deney düzeneğinde, Radyoaktif alfa (a) ışın kaynağı Polonyum (Po) elementinden gelen ışınlar kurşun levhadan geçip ince altın levhaya düşürüldüğünde ışınların çok büyük bir kısmının geçtiği çok az bir kısmının geri döndüğü gözlenmiştir. İnce altın yaprağa gelen α taneciklerin büyük kısmı sapmaya uğramadan geçer. Bazı a tanecikleri çok az sapmaya uğrar. Birkaç tanesi yaprağı geçemez ve tam geri döner. Birkaç tanesi büyük oranda sapmaya uğrar. Bunun sonucunda Rutherford, Bir atomun kütlesinin çok büyük bir kısmı ve pozitif yükün tümü çekirdek adı verilen çok küçük bir bölgede toplanmıştır. Bunlara proton denir. Çekirdekteki proton sayısı atomdan atoma değişir ve sayısı, elementin kütle numarasının yaklaşık yarısına eşittir. Çekirdek dışında proton sayısına eşit sayıda elektron bulunur. Günümüzdeki atom modeline yaklaşarak ilk defa çekirdek fikrini ortaya atmıştır. Elektronların neden çekirdeğe yapışmadığını açıklayamamıştır
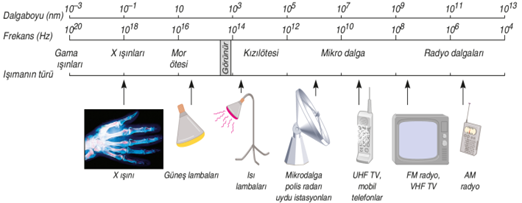

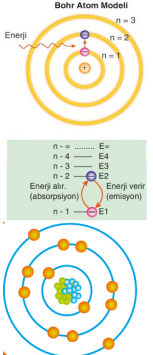
1913-BOHR ATOM MODELİ 1913 yılında Niels Bohr, hidrojenin ışıma spektrumuna dayanarak ve Planck'ın kuantum kuramını göz önüne alarak yeni bir atom modeli önermiştir. Hidrojen atomunun kesikli spektrum çizgileri oluşturmasından hareketle atomdaki elektronların kuantlaşmış enerjilere sahip olabileceğini düşündü.
Bohr atom modeline göre; 1. Elektronlar çekirdekten belirli uzaklıklardaki dairesel yörüngelerde bulunur. Bu yörüngelere enerji düzeyleri denir ve belirli enerjilere sahiptir. Enerji düzeyleri 1, 2, 3, 4, 5 gibi rakamlarla ya da K, L, M, N, O gibi harflerle gösterilir. 2. Uyarılmış haldeki elektronlar kararsızdır ve temel hale geçmek ister. Elektronlar temel hale geçerken enerji kaybederler. 3. Elektronların en düşük enerji düzeyinde bulunduğu duruma temel hal düzeyi adı verilir. 4. Madde ısıtıldığında, sahip olduğu atomlardaki elektronlar daha yüksek enerji düzeyine geçerler. Bu duruma uyarılmış hal denir. 5. Herhangi bir enerji düzeyinin enerjisi (aynı zamanda elektronun potansiyel enerjisi) En= 2,18.10-18/n2 j ya da En=313,6/n2 kkal bağıntısıyla hesaplanır. 6. Elektronlar yüksek enerjili düzeyden (Ey) düşük enerjili düzeye (Ed) geçtiğinde, enerji düzeylerinin enerjileri arasındaki fark kadar enerjiye sahip ışınlar yayılır.
Bohr, hidrojen atomunun enerji düzeyleri arasında elektronun geçişleri neticesinde yayılan ışımaların frekanslarını hesaplayacak bir formül oluşturmuştur.
Hidrojen atomundaki bir elektronun enerji düzeyleri arasındaki geçişlerde soğurulan veya yayınlanan enerji her bir enerji düzeyinin sahip olduğu enerji
Enerji Serileri


1914- Moseley : Çekirdek yüklü protonlardan kaynaklanır. Rutherford çekirdekteki proton sayısını yani çekirdek yükünü tayin edememişti. Moseley katot ışınları tüpünde anot olarak farklı elementler kullandı. Her elementin farklı dalga boyunda x ışını yaydığını gözledi. Yayılan x ışınlarının atomun çekirdek yüküne bağlı olduğunu bununda protonlardan kaynaklandığını söyledi. Yapılan çalışmalar sonucu her elementin çekirdek yükünün proton sayısına eşit olduğu görüldü. Moseley yaptığı deneylerde; Moseley; X-ışınları tayflarına dayanarak, atom numaralarını doğru olarak hesaplamayı başarmıştır. Moseley; Kimyasal değişmelerde, çekirdek yükünün korunduğunu ispatlamıştır. Moseley; Elemente kimyasal özelliğini kazandıran taneciğinde çekirdek yükünün olduğunu ispatladı. Moseley; Çekirdek yüküne, atom numarası dedi. Moseley; Nötral atomlarda çekirdek yükü, elektron sayısına eşittir. Moseley; o güne kadar periyodik tabloda eksik olan elementlerin atom numaralarını tespit etmiştir. PROTON: Moseley, X-ışınları tayflarına dayanarak, atom numaralarını doğru olarak hesaplamayı başarmıştır. Moseleyin deneyi yukarıda açık biçimde verilmiştir. Moseley, atomun çekirdeğinde bulunan bu + yüklü taneciklere proton adını vermiştir. Atom numarası olarak bilinir. Çekirdek yükünü belirler. Atoma kimyasal özelliğini kazandıran taneciklerdir. Nötr atomlarda proton sayısına eşittir.
