
De Broglie elektron gibi atom altı parçacıkların bazen dalga özelliği taşıdığını ileri sürdü E = h.c/λ E=m. ???? 2 bu iki eşitlik birleştirildi. h.c/λ = m. ???? 2à λ = h/????.V Và ışık hızı Bu denklem hareket halindeki bir taneciğin dalga gibi, dalganın da tanecik gibi düşünülebileceğini ifade eder.

İnce bir nikel levha üzerine elektron demeti gönderdiklerinde X ışınları ile elde edilene benzer iç içe halkalar gördüler. Böylece elektronların dalga özelliğine sahip olduğu kanıtlandı.

1925-Paulià Dışlama ilkesi 1920’li yıllarda plank’ın kuantum yaklaşımlarından bazı çıkarsamalar yapıldı çekirdeğin çevresindeki elektronların orbital denilen bir olasılık bulutu içerisinde hareket ettiği söylendi. Paulide bu düşünceleri geliştirerek bir orbitalde birbirine zıt spinli en çok iki elektron bulunabileceğini söyledi. Pauli ilkesine ilerde tekrar değinilecektir.

1926- Scrhödingerà Atom dalga modelià Modern atom teorisi Scrhödinger geliştirdiği denklemle elektronun tanecik ve dalga davranışını inceledi. Kendinden önceki düşünceleri harmanlayarak atomun dalga Mekaniğini ortaya attı. Denklem hidrojen atomundaki elektronun tam yerini belirleyemezken elektronun nerede olduğunu açıklıyordu. Böylece orbital kavramı gelişti. Orbital kavramıyla elektronların yerinin belirlendiği denklemle artık atomla ilgili birçok perde ortadan kalkmış ve soyut kavramlarda olsa atom açıklanabilmiştir. İnsanoğlunun kendini zamanla geliştirdiğini zaman içerisinde görmekteyiz. Bu gelişme hiç durmadan devam edecek ve daha bilinmeyen birçok şey açıklanmaya devam edecektir.

n,l ve ???????? kuantum sayıları hidrojen atomu için Scrhödinger denkleminin çözümünden ortaya çıkmıştır. Bir elektronun dalga fonksiyonu bir orbitali tanımlar. Shrödinger elektronların yerlerini tesbit edebiliyor, elektronların yoğun olarak bulundukları bölgelere orbital dedi. Yani elektronun bulunma olasılığının yüksek olduğu yerlere orbital denir. Ve bu orbitallar bildiğiniz gibi yörüngelerde bulunur. s,p,d,f gibi orbital çeşitleri vardır. Bu bulunma olasılığı shrödinger denkleminde ψ2 olarak simgelendirilmiştir.
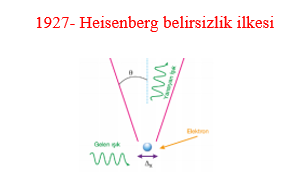
1927- Heisenberg belirsizlik ilkesi
Scrhödinger dalga mekaniğinden yararlanarak belirsizlik ilkesini önerdi. Bir elektronun konumu belirlenirse hızının, Hızının belirlenirse konumunun belirlenemeyeceğini söyledi. Konumu için verilen enerji elektronun hızını, hızını belirlemek için verilen enerji konumunu değiştirecek ve bir belirsizlik doğacaktı.

1932- James Chadwichà Nötronların keşfi İnce berilyum levha üzerine α ışınları gönderildi. Berilyum metalinin çok yüksek enerjili elektirik yükü taşımayan ve kütlesi protonun kütlesinden biraz daha büyük olan ışınlar yaydığını gördü. Bunlara nötron adı verdi. Kütle Numarası(a)=Proton sayısı +Nötron sayısı şimdi bizi ilgilendiren atomla ilgili bazı kuantum ifadelerini inceleyelim.
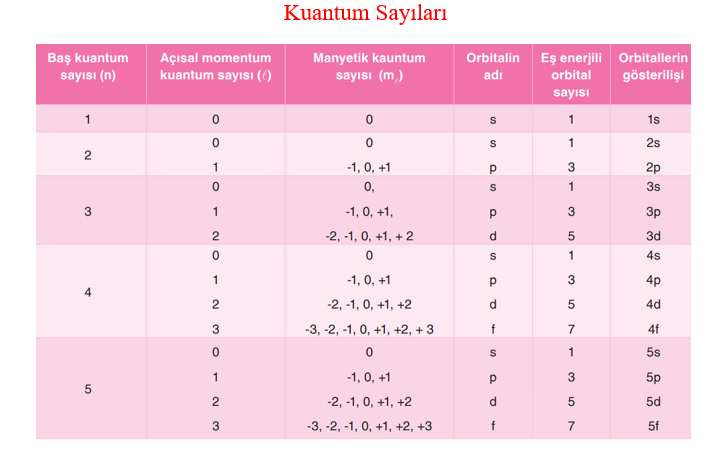
Kuantum sayıları, atomdaki her bir elektronun hangi enerji düzeyinde bulunduğunu belirlemek için kullanılan sayılardır. Bunlar, Baş kuantum sayısı (n)
Açısal momentum (ikincil) kuantum sayısı (l )
Manyetik kuantum sayısı (ml ) dır.
Bu üç kuantum sayısı elektronların bulunma olasılığının en yüksek olduğu yerlerin ve bu yerlerdeki elektronların belirlenmesinde kullanılırken diğer bir kuantum sayısı, Spin kuantum sayısı (ms) ise elektronun davranışını belirlemede kullanılır.

Baş Kuantum Sayısı (n)
Orbitalin çekirdeğe olan uzaklığını belirtir. n ile sembolize edilen bu sayı elektronun ait olduğu katman veya enerji düzeyini gösterir. n pozitif bir tamsayıdır. Enerji katmanları baş kuantum sayıları ile belirtildiği gibi harflerle de gösterilir.
Açısal Momentum (İkincil) Kuantum Sayısı (l)
Elektron bulutlarının şekillerini ve bu şekil farkı ile oluşan enerji seviyelerindeki değişimleri belirtir. l ile gösterilir ve 0 ile n–1 arasındaki tam sayılar kadar değer alabilir. l 'nin her bir sayısal değerine karşılık s, p, d, f gibi harfler gösterilir.

Manyetik Kuantum Sayısı (ml )
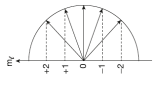
Orbitalin uzaydaki yönlenmesini gösterir. (2l + 1) kadar farklı değer alır ve alt tabakadaki orbital sayısı belirlenir. ml 'nin alabileceği değerler –l 'den +l 'ye kadardır.

Spin Kuantum Sayısı (ms)
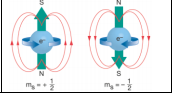
Bir orbitaldeki elektronların kendi eksenleri etrafında dönme yönünü belirtir. Dönme hareketi birbirine zıt iki yönde olur. Bu nedenle spin kuantum sayısı ms + ½ veya - ½ değerlerini alabilir. Spin kuantum sayısı, her orbitalde ancak iki elektronun bulunabileceğini gösterir.
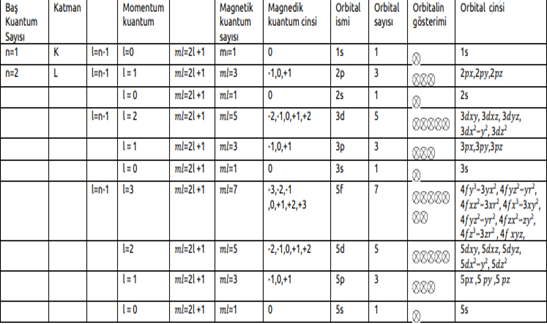

Orbitallerin Türleri ve Şekilleri Elektronun atomda bulunma olasılığının olduğu bölge çekirdekten başlar sonsuza kadar gider. Baş kuantum sayısı kaç olursa olsun elektron bulutlarının (orbitallerin) şekilleri yalnızca l'ye bağlıdır. Baş kuantum sayısı büyüdükçe orbitalin büyüklüğü artar.
s Orbitalleri: Çekirdekten uzaklaştıkça elektron yoğunluğu azalan küre biçimindeki orbitallerdir. Her enerji seviyesinde bir tane s orbitali bulunur. En fazla 2 elektron alır. Tüm s orbitallerinin açısal momentum kuantum sayısı 0' dır.
p Orbitalleri: n = 2 düzeyinden itibaren her enerji seviyesinde bulunur.
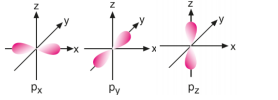
d Orbitalleri: Birinci ve ikinci temel enerji seviyelerinde d orbitali bulunmaz.
