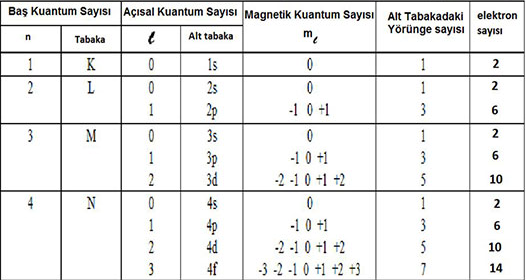
Baş Kuantum Sayısı (n)
| n | Enerji Katmanlarının Harfleri |
|---|---|
| 1 | K |
| 2 | L |
| 3 | M |
| 4 | N |
| 5 | O |
| 6 | P |
| 7 | Q |
Orbitalin çekirdeğe olan uzaklığını belirtir. n ile sembolize edilen bu sayı elektronun ait olduğu katman veya enerji düzeyini gösterir. n pozitif bir tamsayıdır. Enerji katmanları baş kuantum sayıları ile belirtildiği gibi harflerle de gösterilir.
Açısal Momentum (İkincil) Kuantum Sayısı (l)
Elektron bulutlarının şekillerini ve bu şekil farkı ile oluşan enerji seviyelerindeki değişimleri belirtir. l ile gösterilir ve 0 ile n–1 arasındaki tam sayılar kadar değer alabilir. l 'nin her bir sayısal değerine karşılık s, p, d, f gibi harfler gösterilir.
l = 0, 1, 2 ..... (n – 1)
n= 1 ise l = 0'dır.
n= 2 ise l = 0 ve l = 1'dir.
n= 3 ise l = 0, l = 1 ve l = 2'dir.
n= 4 ise l = 0, l = 1, l = 2 ve l = 3'tür.
| l sayısı | Orbital İsmi |
|---|---|
| 0 | s |
| 1 | p |
| 2 | d |
| 3 | f |
| 4 | q |
Manyetik Kuantum Sayısı (ml )
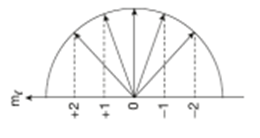
Orbitalin uzaydaki yönlenmesini gösterir. (2l + 1) kadar farklı değer alır ve alt tabakadaki orbital sayısı belirlenir. ml 'nin alabileceği değerler –l 'den +l 'ye kadardır.
ml = –l .......... 0 ........ + l l = 0 için ml = 0 olur.
l = 1 için ml = –1, 0, +1 olur.
l = 2 için ml = –2, –1, 0, +1, +2 olur.
l = 3 için ml = –3, –2, –1, 0, +1, +2, +3 olur.
Verilen l değeri için kaç tane ml değeri olduğu ml = 2l + 1 eşitliği ile belirlenir.
Spin Kuantum Sayısı (ms)
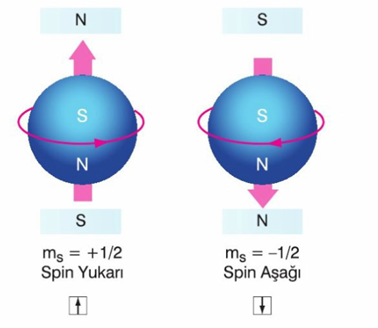
Bir orbitaldeki elektronların kendi eksenleri etrafında dönme yönünü belirtir. Dönme hareketi birbirine zıt iki yönde olur. Bu nedenle spin kuantum sayısı ms + ½ veya - ½ değerlerini alabilir. Spin kuantum sayısı, her orbitalde ancak iki elektronun bulunabileceğini gösterir.
Orbitallerin Türleri ve Şekilleri
Elektronun atomda bulunma olasılığının olduğu bölge çekirdekten başlar sonsuza kadar gider. Baş kuantum sayısı kaç olursa olsun elektron bulutlarının (orbitallerin) şekilleri yalnızca l'ye bağlıdır. Baş kuantum sayısı büyüdükçe orbitalin büyüklüğü artar.
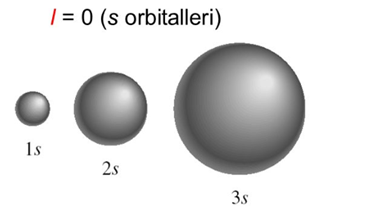
s Orbitalleri:
Çekirdekten uzaklaştıkça elektron yoğunluğu azalan küre biçimindeki orbitallerdir. Her enerji seviyesinde bir tane s orbitali bulunur. En fazla 2 elektron alır. Tüm s orbitallerinin açısal momentum kuantum sayısı 0' dır.

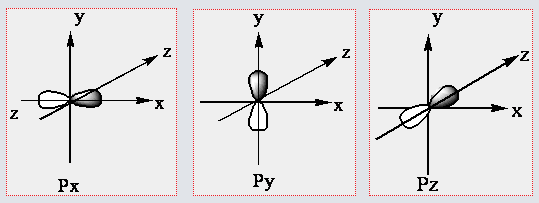
p Orbitalleri:
n = 2 düzeyinden itibaren her enerji seviyesinde bulunur.
d Orbitalleri:
Birinci ve ikinci temel enerji seviyelerinde d orbitali bulunmaz.
Şekilleri incelendiğinde ikisinin (3dx2 – y2 , 3dz2 ) koordinat eksenleri üzerinde diğer üçünün de (3dxy, 3dxz, 3dyz) simetri eksenleri üzerinde bulunduğu görülür. Orbitaller arasındaki fark uzaydaki yönelişlerinden kaynaklanmaktadır.
ORBİTALLERİN ENERJİLERİ
Elektron dizilimini yapabilmek için öncelikle orbitallerin enerjilerinin karşılaştırılması bilinmelidir. Hidrojen gibi tek elektronlu sistemlerde elektronun sahip olduğu enerji yalnızca baş kuantum sayısına (n) bağlıdır. Çok elektronlu atomlarda elektronların sahip olduğu enerjiler n değeri yanında l ile de ilişkilidir. Kletchkowski–Madelung İlkesi: Elektronlar (n + l ) değeri küçük olan orbitalden başlanarak yerleşir. Çünkü (n + l ) değeri arttıkça orbital enerjisi artar. (n + l ) değeri aynı ise n sayısı büyük olan orbitalin enerjisi yüksektir.
| Orbital | n + l değeri | Orbital | n + l değeri |
|---|---|---|---|
| 1s | 1 + 0 = 1 | 4s | 4 + 0 = 4 |
| 2s | 2 + 0 = 1 | 4p | 4 + 1 = 5 |
| 2p | 2 + 1 = 2 | 4d | 4 + 2 = 6 |
| 3s | 3 + 0 = 3 | 4f | 4 + 3 = 7 |
| 3p | 3 + 1 = 4 | 5s | 5 + 0 = 5 |
| 3d | 3 + 2 = 5 | 5p | 5 + 1 = 6 |
Buna göre orbitallerin enerji sıralaması aşağıdaki gibidir.
