KARBON KİMYASINA GİRİŞ
ORGANİK VE İNORGANİK BİLEŞİKLER
| Organik Bileşikler | Anorganik Bileşikler |
|---|---|
| Yanıcıdır. | Genellikle yanıcı değildir. |
| Erime noktaları oldukça düşüktür. | Erime noktaları oldukça yüksektir. |
| Genellikle suda çözünmez. | Birçoğu suda çözünür. |
| Genellikle kovalent yapıdır. | Genellikle iyonik yapıdır. |
| Organik tepkimeler için fazla ısı ve zaman gerekir. | Anorganik bileşik tepkimeleri daha az ısı ve zaman gerektirir. |
| Çoğunluğunun kendine özgü kokusu vardır. | Genellikle kokusuzdur. |
| Organik reaksiyonlar genellikle yavaş gerçekleşir. | Anorganik reaksiyonlar genellikle hızlı gerçekleşir. |
Vitalizm:
Organik bileşiğin elde edilebilmesi için yaşam gücünün işe karışması gerektiğini söyleyen bir inançtır.
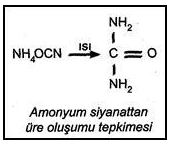
Friedrich Wöhler 1828 yılında anorganik bileşiklerden yola çıkarak laboratuar koşullarında ilk organik bileşiği sentezledi. Wöhler, anorganik bir bileşik olan amonyum siyanatın sulu çözeltisinin buharlaştırılmasıyla organik bir bileşik olan üreyi elde etmiştir.
Karbon Atomunun Bağ Yapma Özelliği
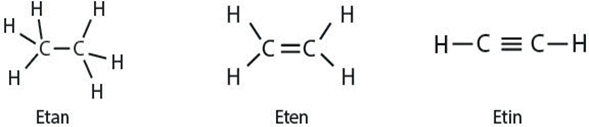
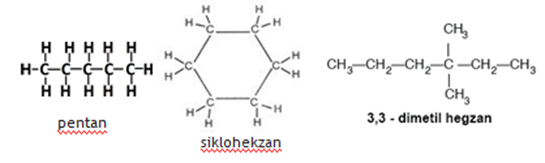
Karbon atomları diğer atomlardan farklı olarak sonsuz sayıda birbirine bağlanarak düz zincirli, dallanmış ya da halkalı yapıya sahip çok sayıda bileşik oluşturabilir.
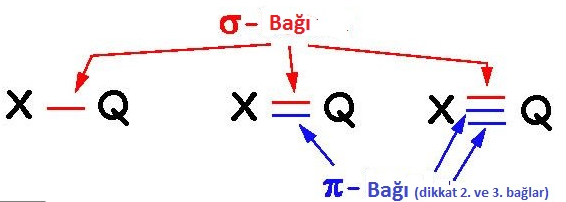
Karbon atomları arasında kurulan bağ diğer bağlara göre daha kararlıdır.Karbon atomları arasındaki tekli, ikili ve üçlü bağlardan enerjisi en yüksek olan üçlü bağdır. Bu bağı kırmak için gereken enerji diğerlerinden fazladır.
Karbon Elementinin Allotropları Tekli bağlar sigma bağı, ikili bağlardan biri sigma diğeri pi, üçlü bağlardan biri sigma ikisi pi bağıdır.
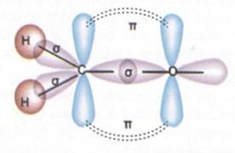
Karbon Elementinin Allotropları
Grafit:
C atomları üst üste yığılmış geniş, yassı levhalar oluşturacak biçimde iki boyutlu düzlemde birbirine bağlanmıştır. İyi bir yağlayıcıdır. Elektriği iletir. Pilde ve elektrolizde elektrot olarak kullanılır.
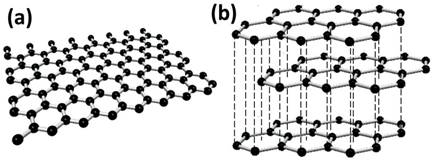
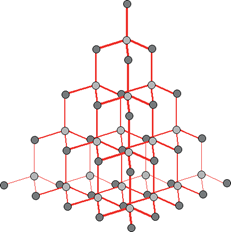
Elmas:
Kristal bir yapıya sahiptir. Her bir karbon atomu 4 başka karbon atomuna bağlıdır. Elektriği iletmez, tepkimeye girme isteği düşüktür. Erime ve kaynama noktası yüksektir. E.N: 3500 C. Cam kesici, taş yontucu olarak kullanılır. Optik özelliklerinden dolayı değerlidir.
Fullerenler:
Bu yapı bir futbol topu ve belirli jeodezik kubbelere benzediği için fulleren adı verildi. Grafitin lazerle buharlaştırılarak yoğunlaştırılması ile elde edilir.
C12, C60, C70, C74, C82 formüllerine sahip fulleren keşfedildi.
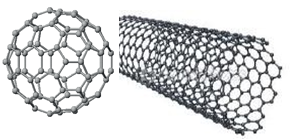
Nanotüpler:
Grafen tabakası denilen altıgen karbon halkalarından oluşmuş iki boyutlutabakaların tıpkı bir kağıt gibi kıvrılarak silindir şekline getirilmiş halidir.
Nanotüplerin uzunluğu çaplarının 100 milyon katıdır. Nanotüpler güçlü ve iletken lifler oluşturabilir.