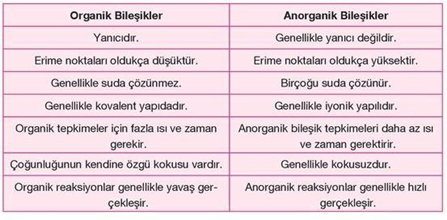
KARBON KİMYASINA GİRİŞ ORGANİK VE İNORGANİK BİLEŞİKLER
Vitalizm: Organik bileşiğin elde edilebilmesi için yaşam gücünün işe karışması gerektiğini söyleyen bir inançtır.
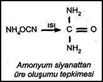
Friedrich Wöhler 1828 yılında anorganik bileşiklerden yola çıkarak laboratuar koşullarında ilk organik bileşiği sentezledi. Wöhler, anorganik bir bileşik olan amonyum siyanatın sulu çözeltisinin buharlaştırılmasıyla organik bir bileşik olan üreyi elde etmiştir.
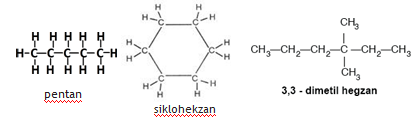
Organik Bileşiklerin Basit ve Molekül Formülleri
Organik bileşiklerin yapısında bulunan atomların türlerini, sayılarını, birbirlerine oranlarını ve üç boyutlu yapılarını ifade eden formülleri vardır. Bu formüller organik bileşiklerin sınıflandırılmasında da kullanılır. Organik bileşiklerdeki elementlerin türünü, atom sayılarının birbirine oranlarını gösteren formüle basit formül (kaba formül) denir. Bu formülde elementlerin mol sayıları en küçük tam sayılarla yazılır. Bir bileşiğin basit formülünden, • Bileşiği oluşturan atomların türü,
• Atom sayılarının oranları,
• Elementlerin atom kütleleri biliniyorsa bileşiği oluşturan elementlerin kütleleri oranı ve kütlece yüzde bileşimleri bulunabilir.
Organik bileşiği oluşturan elementlerin gerçek atom sayılarının verildiği formüle o bileşiğin molekül formülü (gerçek formül) denir. Bir bileşiğin molekül formülü ile,
• Bileşiği oluşturan atomların türü,
• Atom sayıları ve atom sayılarının oranları,
• Elementlerin atom kütleleri biliniyorsa bileşiğin molekül ağırlığı, atomların kütlece yüzde bileşimleri ve elementlerin kütleleri oranı bulunabilir. Molekül formülü, basit formülün kütle ya da atom sayısı cinsinden genişletilmiş hâli şeklinde düşünülebilir.
n .(Basit formül) = Molekül formülü
n (Basit formülü verilen bileşiğin molekül kütlesi) = Molekül kütlesi
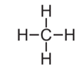
Bir moleküldeki atomların gerçek sayılarının ve bağlanma şekillerinin gösterildiği formüle yapı formülü (açık formül) denir. Örneğin CH4 molekülünün yapı formülü
Doğada Karbon
Karbon Atomunun Bağ Yapma Özelliği
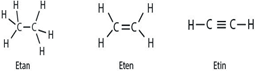
Karbon atomları diğer atomlardan farklı olarak sonsuz sayıda birbirine bağlanarak düz zincirli, dallanmış ya da halkalı yapıya sahip çok sayıda bileşik oluşturabilir.
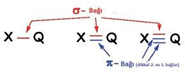
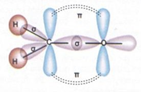
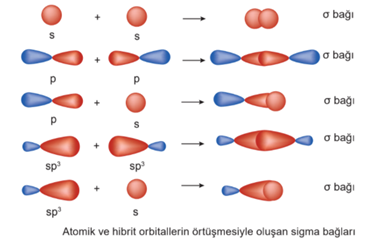
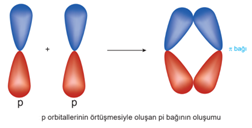
Karbon atomları arasında kurulan bağ diğer bağlara göre daha kararlıdır. Karbon atomları arasındaki tekli, ikili ve üçlü bağlardan enerjisi en yüksek olan üçlü bağdır. Bu bağı kırmak için gereken enerji diğerlerinden fazladır. Karbon Elementinin Allotropları Tekli bağlar sigma bağı, ikili bağlardan biri sigma diğeri pi, üçlü bağlardan biri sigma ikisi pi bağıdır.
Karbon Elementinin Allotropları
Grafit: C atomları üst üste yığılmış geniş, yassı levhalar oluşturacak biçimde iki boyutlu düzlemde birbirine bağlanmıştır. İyi bir yağlayıcıdır. Elektriği iletir. Pilde ve elektrolizde elektrot olarak kullanılır.
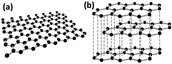
Elmas: Kristal bir yapıya sahiptir. Her bir karbon atomu 4 başka karbon atomuna bağlıdır. Elektriği iletmez, tepkimeye girme isteği düşüktür. Erime ve kaynama noktası yüksektir. E.N: 3500 C. Cam kesici, taş yontucu olarak kullanılır. Optik özelliklerinden dolayı değerlidir.
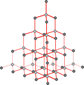
Fullerenler: Bu yapı bir futbol topu ve belirli jeodezik kubbelere benzediği için fulleren adı verildi. Grafitin lazerle buharlaştırılarak yoğunlaştırılması ile elde edilir.
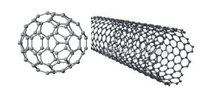
C12, C60, C70, C74, C82 formüllerine sahip fulleren keşfedildi.
Nanotüpler: Grafen tabakası denilen altıgen karbon halkalarından oluşmuş iki boyutlu tabakaların tıpkı bir kağıt gibi kıvrılarak silindir şekline getirilmiş halidir.
Nanotüplerin uzunluğu çaplarının 100 milyon katıdır. Nanotüpler güçlü ve iletken lifler oluşturabilir.
Organik Bileşiklerin Lewis Yapısı Hibritleşme
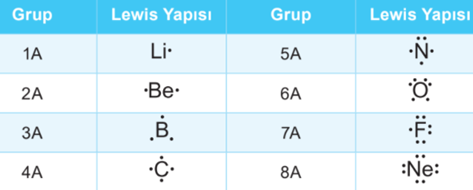
Lewis Yapısı
Elementlerin oluşturacağı kovalent bağ sayısını o elementlerin değerlik elektronları belirler. Bir elementin son katmanındaki elektronlara o elementin değerlik elektronları denir. Elementler kovalent bağ oluştururken değerlik elektronlarını ortaklaşa kullanır. Ancak elementlerin değerlik elektronlarının hepsi bağ oluşumuna katılmayabilir. Molekül formüllerinde bağ oluşumuna katılan elektronlara ortaklanmış (bağlayıcı) elektron denir. Bir bağ ortaklaşa kullanılan iki elektrondan oluştuğundan bağı oluşturan elektronlar bağlayıcı elektron çifti şeklinde ifade edilir. Molekülde bağ oluşumuna katılmayan elektronlara ortaklanmamış elektron, bu elektronlar çift hâlinde bulunuyorsa ortaklanmamış elektron çifti denir.
Örnek :
Hibritleşme
Farklı enerjideki atom orbitallerinin enerjilerini yeniden düzenleyecek yeni orbitaller oluşturmasına hibritleşme (melezleşme) denir. Hibritleşme sonucu oluşan yeni orbitallere de hibrit orbitalleri denir. Hibritleşme, enerji düzeyleri yakın olan orbitaller arasında olur. s ile p arasında sp, sp2 ve sp3 hibritleşmesi olmak üzere üç hibritleşme mevcuttur.
Bileşiklerin Lewis formülü yazılırken işlem basamakları esas alınırsa kolaylık sağlanmış olur.
1. Moleküldeki toplam değerlik elektron sayısı bulunur.
2. Moleküldeki her atomun dublet, ya da oktetini tamamlaması için gerekli elektron sayısı bulunur ve toplanır.
3. 2. adımda bulunan toplam elektron sayısı ikiye bölünerek moleküldeki bağ sayısı bulunur.
4. Bağlar atomlar arasına yerleştirilir. Bağ yapmayan elektronlar atomların çevresine okteti sağlanacak şekilde dağıtılır.
Merkez Atomun Hibrit Türünü Bulma
· Merkez atomu çevresindeki doğrultular sayılır.
· Bu doğrultulardan her biri moleküldeki merkez atomunun en dış katmanında bir orbitale karşılık gelir.
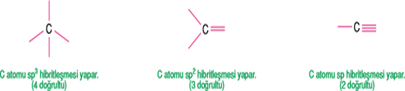
· Merkez atomu etrafında 2 doğrultu varsa sp, 3 doğrultu varsa sp2, 4 doğrultu varsa sp3 hibritleşmesi vardır.
· C atomunda;
Sadece tek bağ oluşturan karbon atomu sp3 hibritleşmesi yapar.
İkili bağ oluşturan karbon sp2 hibritleşmesi yapar (p orb. biri hib. katılmaz).
Üçlü bağ oluşturan karbon atomu sp hib. yapar. (p orb. ikisi hib. katılmaz).
Molekül Geometrisi
Merkez atomun ve merkez atoma bağlı diğer atomların üç boyutlu ortamda uzanımları sonucunda oluşan şekle molekül geometrisi denir.
Molekül geometrisi, değerlik kabuğu elektron çifti itme kuramına (VSPER) göre belirlenir.
Molekül geometrisi belirlenirken, hibrit orbitallerinin özdeş olması ve üç boyutlu mekanda birbirinden olabildiğince uzak durması (aradaki açının en büyük olması) ilkesinden yararlanılır.

A, merkez atomunu; E, elektron çiftini; X, bağlı bir atomu göstermek üzere bazı moleküllerin molekül geometrisi, merkez atomun hibritleşme türü ve bağ açısı tabloda verilmiştir.