

BRÖNSTED-LOWRY ASİT/BAZLARI
Bu tanıma göre proton (H+) veren maddeler asit, proton (H+) alan maddeler bazdır ve asit-baz tepkimelerinde proton, asitten baza aktarılır. Aralarında bir proton farkı olan asit-baz çiftine eşlenik (konjuge) asit-baz çifti denir.
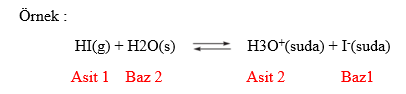
Asit ve Bazların Kuvveti Asit ve bazların kuvveti suda iyonlaşma derecesine bağlıdır. Suda çözündüğünde %100 iyonlaştığı varsayılan asit-baza kuvvetli asit-baz denir. Kuvvetli asit-bazın suda tamamen iyonlaştığı varsayıldığı için çözünme tepkimeleri tek yönlü okla gösterilir.
Suda kısmen iyonlaştığı varsayılan asit ve baza zayıf asit-baz denir. Zayıf asitlerin ve bazların kısmen iyonlaşması iyonlaşma denge sabiti ile ilgilidir. Suda kısmen iyonlaştıkları için çözünme tepkimeleri çift yönlü okla gösterilebilir.
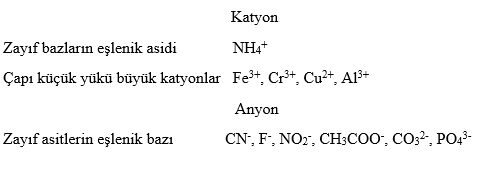
Zayıf bazların eşleniği olan katyonlar asidik, zayıf asitlerin eşleniği olan anyonlar bazik özelliğe sahiptir. Bu durumda bazı katyonların su ile etkileşerek asit, bazı anyonların da su ile etkileşerek baz gibi davrandığı söylenebilir.
Asit Gibi Davranan Katyonlar Zayıf bazların eşlenik asitleri ile çapları küçük, yükleri büyük olan Fe3+, Cr3+, Cu2+ gibi katyonlar asidik özellik gösterir. NH3 gibi zayıf bazların eşlenik asitleri su ile tepkimeye girdiklerinde proton verici olarak davranır.
Baz Gibi Davranan Anyonlar Zayıf asitlerin eşlenik bazları olan bütün anyonlar su ile tepkimelerinde proton alıcısı olarak davrandıkları için bazik özellik gösterir.
Örneğin HCN’ün su ile tepkimesinden oluşan CN- iyonu su ile tepkimeye girdiğinde eşlenik asidini oluştururken OH- iyonu oluşmasına neden olur.

Kuvvetli Asit ve Bazların pH Değeri Zayıf asitler ve zayıf bazlar suda kısmen iyonlaştıklarından çözeltilerinin pH değerlerini hesaplamak için iyonlaşma denge bağıntısından ve denge sabitinden yararlanılır.

Tampon Çözeltiler
Az miktarda asit ya da baz eklendiğinde ortamın pH değerinin değişmesine direnç gösteren çözeltilere tampon çözeltiler denir. Tampon çözeltiler zayıf eşlenik asit-baz çözeltilerinden oluşur. Tampon çözeltinin pH direnci tamponu oluşturan asit ve onun eşlenik bazının miktarına bağlıdır. Genel olarak tampon çözeltiler içerdikleri maddeler ile ifade edilir. Tuz/asit veya eşlenik baz/asit gibi.
Tuzların Asit – Baz Özelliği
Asit ve bazların tepkimesinden oluşan iyonik bileşiklere tuz denir. Tuzlar çeşitli şekillerde (kuvvetli asit ve kuvvetli bazdan, zayıf asit ve kuvvetli bazdan, kuvvetli asit ve zayıf bazdan veya zayıf asit ve zayıf bazdan) oluşabilir. Tuzlar suda çözündüklerinde iyonlarına ayrışır. Oluşan iyonlar su ile tepkimeye girebilir. Bir iyonun su ile tepkimeye girerek zayıf asit veya baz oluşturmasına hidroliz denir. Tuzlar suda çözündüklerinde asidik, bazik ve nötr çözelti oluşturabilir.
Nötr Tuz
Suda çözündüğünde nötral çözelti oluşturan tuzlara nötr tuz denir. Nötr tuzlar kuvvetli bir asitle kuvvetli bir bazın tepkimesi sonucunda oluşur. Nötr tuzları oluşturan anyon ve katyonlar önemli ölçüde hidroliz olmaz.
Asidik Tuz
Kuvvetli bir asit ve zayıf bir bazdan oluşan tuzlar asidik özellik gösterir. Oluşan iyonlardan zayıf bazdan gelen katyon hidroliz olurken kuvvetli asitten gelen anyon hidroliz olmaz.
Bazik Tuz
Kuvvetli bir baz ve zayıf bir asitten oluşan tuzlar bazik özellik gösterir. Oluşan iyonlardan kuvvetli bazdan gelen katyon hidroliz olmazken zayıf asittten gelen anyon hidroliz olur.
KUVVETLİ ASİT-BAZ TİTRASYONU
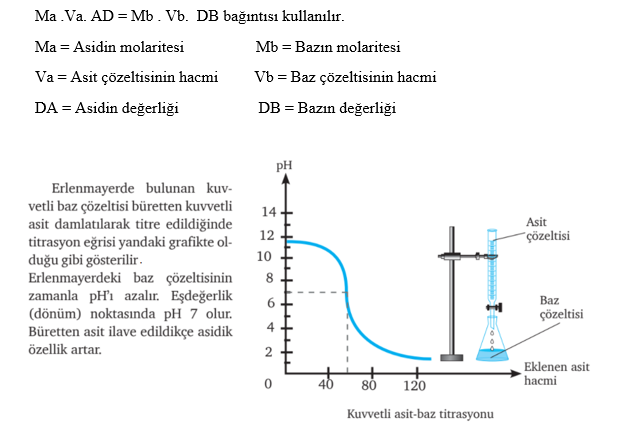
Hacmi bilinen ancak derişimi bilinmeyen bir asidin (veya bazın) hacmi ve derişimi bilinen bir baz (veya asit) yardımı ile asidin (veya bazın) derişiminin bulunmasında kullanılan yönteme titrasyon denir. Titrasyon yönteminde hacmi ve derişimi belli olan çözeltiye standart çözelti denir.
Titrasyon yönteminde standart çözelti bürete, derişimi belli olmayançözelti erlenmayere konur. Erlenmayerdeki çözeltiye ortamın pH değişimini belirleyecek indikatör damlatılır. İndikatör, ortamın pH aralığına göre renk değiştiren organik veya inorganik maddelerdir. Büretteki standart baz çözeltisi erlenmayerdeki asit çözeltisine ilave edildikçe çözeltideki asidik özellik azalır. Ortam nötr oluncaya kadar işleme devam edilir. Büretteki çözeltinin renk değiştirdiği noktaya eşdeğerlik noktası veya dönüm noktası denir.
Eşdeğerlik noktasında yani nötralleşme tam olarak gerçekleştiğinde asitten gelen H+(H3O+) ile bazdan gelen OH- iyonlarının mol sayıları eşittir.
ÇÖZÜNME-ÇÖKELME TEPKİMELERİ
AgBr gibi suda az çözünen maddenin bir miktarı suya ilave edildiğinde bir süre sonra AgBr’nin doymuş çözeltisi oluşur. Doymuş AgBr çözeltisinde az çözünen AgBr katısı ile katıyı oluşturan Ag+ ve Br- iyonları suda denge hâlindedir. Bu denge çözünürlük dengesi olarak aşağıdaki gibi yazılır.
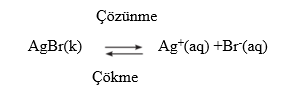
AgBr suda kısmen çözünür. Tepkimeyi oluşturan maddeler farklı fiziksel hâlde olduklarından tepkime heterojendir. Tepkimede yer alan AgBr katısının derişimi sabitttir. Denge bağıntısında katı hâldeki maddeler yer almayacağı için çözünürlük denge bağıntısı
Kçç=[Ag+][Br-] şeklinde yazılır.
Buradaki Kçç’ye çözünürlük çarpımı sabiti veya çözünürlük çarpımı denir. Kçç ‘de iyonların katsayısı üs olarak yazılır.
Tuzların Çözünürlüğüne Etki Eden Faktörler
1. Sıcaklık Katıların çözünürlüğü genelllikle endotermik olduğundan sıcaklık arttıkça tuzların suda çözünmeleri de artar. İyonik bir katı, suda çözündüğünde maksimum düzensizlik artar. Sıcaklık artışı endotermik tepkimelerde çözünmeyi artırırken ekzotermik tepkimelerde çökelmeyi artırır.
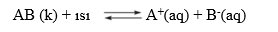
AB tuzunun suda çözünmesi endotermiktir. Sıcaklığın artırılması dengenin ileri yönde (çözünme) ilerlemesini sağlar. Dengenin çözünme yönünde ilerlemesi maksimum düzensizliği ve çözünürlüğü artırırken Kçç değeri de artar. Endotermik tepkimelerde sıcaklığın azaltılması tepkimenin geri yönde (çökelme) olmasını sağlarken maksimum düzensizliği azaltır, Kçç değerini küçültür.
2. Ortak İyon Etkisi XY katısı saf su yerine bu katıdaki iyonu içeren bir çözeltide çözünürse bu çözeltideki çözünürlüğü saf sudaki çözünürlüğünden az olur. Çünkü ortak iyon, çözünürlüğü azaltır. Ortak iyonun derişimi arttıkça çözünürlük azalır.
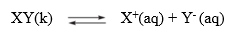
XYtuzunun X+ iyonları içeren bir çözeltide çözündüğü düşünülürse ortamdaki X+ iyonları derişimi artar. Le Chatelier İlkesiʼne göre sistem çözeltideki X+ iyonları derişimini azaltmak için geri yönde ilerler. Tepkimenin geri yönde ilerlemesi XY tuzunun çökmesine neden olur. Böylece XYʼün çözünen miktarı, dolayısıyla çözünürlüğü azalmış olur.