
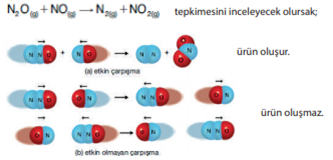
Çarpışma Teorisi: Tepkimelerin, taneciklerin çarpışmasıyla gerçekleştiğini ifade eden teoriye çarpışma teorisi denir. Çarpışmanın kimyasal reaksiyonla sonuçlanması için uygun doğrultu ve yönde (geometride) yeterli enerjiye sahip olması gerekir. Bu tür çarpışmaya etkin çarpışma denir. Çarpışma sonunda ürün oluşmuyorsa bu çarpışma etkin olmayan çarpışmadır.
Aktifleşme Enerjisi Bir kimyasal tepkimedeki taneciklerin çarpışarak ürüne dönüşebilmeleri için gerekli minimum enerjiye eşik enerjisi veya aktifleşme enerjisi denir. Aktifleşme enerjisi ne kadar büyükse tepkime o kadar yavaş gerçekleşir.
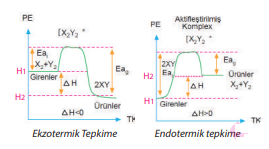
ΔH = Eai - Eag
ΔH = H2 - H1
Grafiğin tepe noktasında kararsız olan aktifleşmiş kompleks maddesi oluşur. Şartlar uygun olursa aktiktifleşmiş kompleks ürüne dönüşür. Aktifleşmiş kompleks yüksek enerjili ve kararsız haldir.
Bir tepkimenin gerçekleşmesi için;
Derişim ve Hız
Reaksiyon hızı (r) birim zamanda madde miktarındaki değişmedir. Madde miktarı olarak gram, mol ve daha çok molar derişim alınır.
Kimyasal reaksiyonlarda tepkenlerin derişimindeki azalmayı ifade etmek üzere eksi (–), ürünlerin derişimindeki artışı ifade etmek için de artı (+) işareti kullanılır.
Hız birimi genellikle mol /L.s alınır
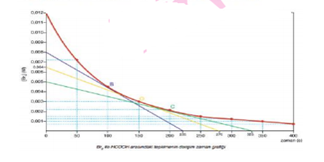
Derişim - Zaman Grafiği
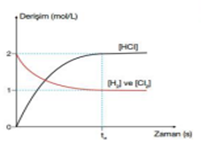
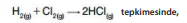
H2 ve Cl2 derişimleri 2 mol/L’dir.
Başlangıç anında kapta HCl derişimi sıfırdır. Tepkime başladığında [H2] ve [Cl2] azalırken, [HCl] artmaktadır.
HCl derişiminin artış hızı, H2 ve Cl2 derişimlerinin azalış hızının iki katıdır. td anında HCl derişimi 2 mol/L, H2 ve Cl2 derişimleri ise 1 mol/L’dir.
Başlangıçta tepkime hızı en yüksekken reaksiyon ilerledikçe tepkime hızı azalmaktadır.
Anlık ve Ortalama Hız
Bir reaksiyona ait çizilen derişim - zaman grafiğinde herhangi bir zamandaki eğrinin eğimi anlık hızı verir. Ortalama hız ise tepkimenin ilerlemesi sırasında herhangi iki zaman aralığı arasındaki hızdır.
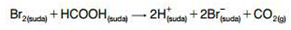

Başlangıç hızı bütün tepkimelerde en yüksektir. Zaman içerisinde anlık hız sürekli azalır. Tepkimenin başlangıcından sonuna kadar hesaplanan ortalama hız da başlangıç hızından küçük, anlık hızlardan ise büyük veya küçük olabilir.
Homojen fazlı tepkimeler, tepkimedeki bütün maddelerin aynı fazda olduğu tepkimelerdir. Tepken ve ürünlerden en az bir tanesinin farklı fazda olduğu tepkimelere de heterojen fazlı tepkimeler denir.
Tepkime hızları renk, basınç-hacim, iletkenlik, ısı, pH gibi niceliklerin değişimi ile ölçülebilir:
Renk Değişimi
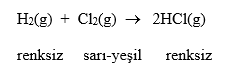
Çözünme-Çökelme
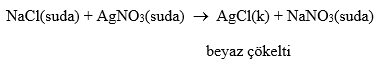
Elektrik İletkenliği Değişimi
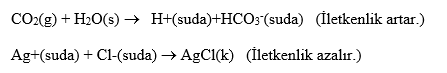
Basınç-Hacim Değişimi

Isı Değişimi
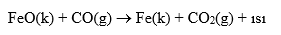
Bunların dışında tepkime hızını ölçmek için tepkimelerin daha başka özelliklerinden (pH değişimi vb.) de yararlanılabilir.