
Hız denklemi yazılırken yalnızca girenler kısmındaki gazlar ve suda çözünmüş maddelerin derişimleri alınır. Saf katı ve sıvılar hız denklemine alınmaz. k, hız sabitidir. k sabiti tepkimenin cinsine, sıcaklığa, katalizöre ve katıların temas yüzeyine bağlıdır.
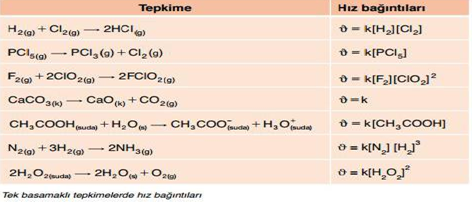
Hız denkleminde tepkimeye girenlerin derişimlerinin üstel toplamına tepkime derecesi (mertebesi) denir. İlk tepkime ikinci derecedendir. İkinci tepkime birinci derecedendir. Üçüncü tepkime üçüncü derecedendir.
Çok Basamaklı Tepkimelerde Hız Bağıntıları
Mekanizmalı (çok adımlı) tepkimelerde hız denklemi, mekanizmadaki en yavaş adımın girenlerine göre yazılır. Hızı belirleyen basamak en yavaş basamaktır.

Deneysel Yollarla Hız Denkleminin Yazılması
2NO(g) + 2H2(g)® N2(g) + 2H2O(g) tepkimesine ait tepkimeye giren maddelerin derişimlerinin değişiminin hıza etkisini gösteren deney sonuçları aşağıda verilmiştir.
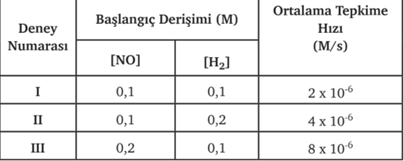
Tablodaki I ve II. deney sonuçları karşılaştırıldığında NO derişimi sabitken H2 derişimi 2 kat artırıldığında hızın 2 katına çıktığı görülür. Bu durum H2 derişiminin hızla doğru orantılı olduğunu gösterir. Benzer şekilde I ve III. deney sonuçları karşılaştırıldığında H2 derişimi sabitken NO derişiminin 2 katına çıkması tepkime hızını 4 kat artırmıştır. NO derişimi de hıza karesi kadar etki etmektedir. Bu ilişki matematiksel olarak aşağıdaki gibi ifade edilebilir.
Hız = k∙[H2]∙[NO]2

Tepkime sırasında kopan ve oluşan bağ sayısı ne kadar fazla isev genellikle tepkime hızı o kadar yavaş olur. İyonlar arasındaki tepkimeler, nötr atomlar arasındaki tepkimelerdenv daha hızlıdır. Zıt yüklü iyonlar arasında gerçekleşen tepkimeler aynı yüklü iyonlarv arasında gerçekleşen tepkimelere göre daha hızlıdır.
Madde derişiminin artması reaksiyon hızının artışına sebep olur. Tepkime hız sabiti (k) derişimle değişmez.
Sıcaklığın arttırılması ile taneciklerin ortalama kinetik enerjileri ve tanecik hızları arttırılmış olur. Sıcaklık arttığında birim zamanda etkin çarpışma sayısı artar ve tepkime hızı artmış olur. Birkaç tepkime dışında; tepkime türü ne olursa olsun (endotermik, ekzotermik) sıcaklık arttığında tepkime hızı artar.
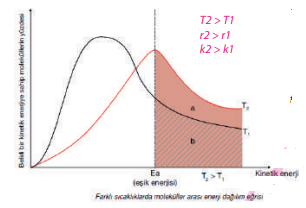
Grafikte Ea ile gösterilen çizgiden itibaren eğri altında kalan alan enerjisi tepkime vermeye uygun taneciklerin sayısını verir. T2 sıcaklığında çizilen eğri, T1 sıcaklığında çizilen eğriye göre daha büyük alan kapladığından T2 sıcaklığında Ea’yı aşan tanecik sayısı daha fazladır. Buna göre T2 sıcaklığındaki tepkime daha hızlıdır. T2 sıcaklığındaki taneciklerin KE’ si daha büyüktür.
Gaz fazındaki tepkimelerde basıncın artmasıyla (hacim azalması) tepkime hızı artar, basıncın azalmasıyla (hacim artması) tepkime hızı azalır.
Tepkimeye girdiği gibi tepkime sonunda miktarı değişmeden çıkan maddelere katalizör denir.
Katalizörler;
Reaksiyon hızını arttıran pozitif katalizörlere aktivatör, reaksiyonları yavaşlatan negatif katalizörlere inhibitör denir.
Reaksiyona giren maddelerle aynı fazda olan katalizörlere homojen katalizör, farklı fazda olanlara heterojen katalizör denir.
Enzimler biyolojik katalizördür ve genellikle homojendir. Bazen tepkimelerde oluşan ürünler katalizör görevi görürler. Bu tür katalizörlere otokatalizör denir.
Enzimler biyolojik katalizördür. Bazı iki basamaklı tepkimelerde bir basamakta oluşan ürün bir sonraki basamağı katalizleyebilir. Bu şekilde birbiri ile yarışan iki reaksiyonun ardışık gerçekleştiği bu tür tepkimelere de osilasyonlu tepkimeler denir.
Tepkimeye giren maddelerin temas yüzeyi arttıkça tepkime hızı artar.