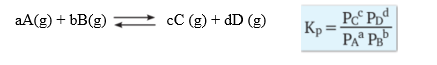Kimyasal türler aralarındaki etkileşimin en az olmasına maksimum düzensizlik, düşük enerjili durumu tercih etmelerine ise minimum enerji eğilimi denir. Suyun buharlaşmasında maksimum düzensizlik, buharlaşan suyun tekrar yağmur olarak yeryüzüne inmesinde ise minimum enerji eğilimi rol oynar. Maddeler enerji alarak katı hâlden sıvı ve gaz hâle geçerken maksimum düzensizlik eğilimi, gaz hâlden sıvı ve katı hâle geçerken de minimum enerji eğilimi gösterir.

Genellikle maksimum düzensizlik ve minimum enerjinin uzlaştığı durumda denge söz konusu olur. Belirli koşullarda maddenin farklı fiziksel hâlleri arasında kurulan dengeye fiziksel denge denir.
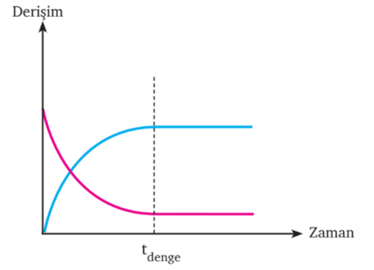
Kimyasal olaylarda da denge söz konusudur. Belirli koşullarda kimyasal bir tepkimede tepkimeye girenlerin ve ürünlerin derişimlerinin zamanla net değişim göstermediği duruma kimyasal denge denir.
Denge anında ;
® Gözlenebilen (makroskobik) değişiklikler durmuş gibi görünse de gözlenemeyen (mikroskobik) değişmeler devam eder. Bu nedenle denge dinamiktir.
® Dengenin dinamik olması girenlerin ürünlere dönüştüğü, aynı hızla ürünlerin tekrar girenleri oluşturduğu, ileri ve geri tepkimenin devam ederek sistemin dengeye geldiğini gösterir.
® Denge hâlinde tepkimedeki girenlerin ve ürünlerin derişimi sabittir.
* Dengenin kurulabilmesi için sistem kapalı, sıcaklık sabit ve tepkime tersinir olmalıdır.
* Tersinir tepkimeler çift yönlü ok ile gösterilir. Tepkimelerde gösterilen çift yönlü ok, tepkimenin hem ileri hem de geri yönde gerçekleşebileceği anlamına gelir.
DENGE SABİTİ
Tersinir bir tepkimede denge anında ürünlerin derişimlerinin tepkimeye girenlerin derişimine oranı denge sabiti olarak tanımlanabilir. Kimyasal türlerin önünde yazılan kat sayıları derişimlerin üzerine üs olarak yazılır. Derişimler cinsinden denge sabiti Kc şeklinde gösterilir. Denge sabiti ‘ K ‘ ile sembolize edilir. Derişimler cinsinden denge sabiti Kc şeklinde gösterilir.

Mekanizmalı tepkimelerde denge sabiti ara basamaklara bağlı değildir. Denge bağıntısı net tepkimeye göre yazılır. Tepkimeye giren ve oluşan ürünlerin hepsi aynı fazda olmayabilir. Tepkimeye katılan maddeler farklı fazda ise ortaya çıkan dengeye heterojen denge denir. Saf sıvı ve katıların derişimi değişmediği için denge bağıntısında yer almazlar.
Denge Kesri Denge sabiti aynı zamanda bir tepkimenin hangi yöne ilerleyeceği hakkında da bilgi verir. Tepkimenin herhangi bir anındaki derişimler denge bağıntısında yerine yazıldığında elde edilen değere denge kesri denir. Denge kesri Qc ile ifade edilir. Elde edilen Qc ile Kc karşılaştırılır.
* Kc = Qc ise tepkime dengededir. Qc tepkimedeki Kc değerinden büyük veya küçükse tepkime dengede değildir.
* Kc > Qc ise sistemin dengeye ulaşabilmesi için tepkime ürünler yönüne hareket eder.
* Kc < Qc ise sistemin dengeye ulaşabilmesi için tepkime girenler yönüne hareket eder.
Kısmi Basınçlar Cinsinden Denge Sabiti Tepkimeyi oluşturan kimyasal türlerin gaz fazında olduğu homojen tepkimelerde derişim yerine kısmi basınç kullanılarak denge sabiti hesaplanabilir. Kısmi basınçla ifade edilen denge sabiti “Kp’’ ile gösterilir. Kp ürünlerin kısmi basıncı ile tepkimeye girenlerin kısmi basıncı arasındaki oranı ifade eder. Aşağıdaki tepkimenin denge sabiti kısmi basınçlarla ifade edilirse