Pil Gerilimini Etkileyen Etmenler
Derişim Etkisi:
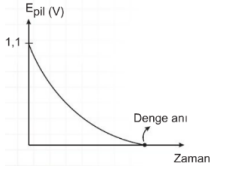
Zn(k) + Cu+2(suda) → Zn+2(suda) + Cu(k) tepkimesinin standart şartlarda E0 pil değeri 1,1 Volttur. İki tür arasındaki elektron alma ve verme eğilimleri arttıkça bu türlerin oluşturdukları pilin gerilimi (Epil) de artar. Yukarıdaki pil sisteminde başlangıçta elde edilen 1,1 V değeri zamanla azalır, çünkü redoks tepkimesi zamanla dengeye ulaşır. Pil tepkimesi dengeye ulaştığında pil potansiyeli sıfır olur ve pil çalışmaz.
Epil = 0 olduğunda sistem dengededir ve pil çalışmaz.
Standart pil potansiyelleri 25°C deki çözeltiler için 1 M derişim ve gazlar için 1 atm basınç değeriyle hesaplanırken, ortam koşulları değiştiğinde elektrot potansiyelleri Le Chatelier ilkesine göre hesaplanır. Le Chatelier ilkesine göre tepkimeye girenlerin derişiminin arttırılması tepkimeyi ürünler yönüne, ürünlerin derişiminin arttırılması da tepkimeyi girenler yönüne kaydırır.
Zn(k) + Cu+2(suda) = Zn+2(suda) + Cu(k)
denge tepkimesi için
Kc = [Zn+2]/[Cu+2] dir.
aA(k) + bB+(suda) = aA+(suda) + bB(k)
Buna göre, boşalmış bir pili yeniden çalıştırabilmek için [Cu+2] derişimi artırılmalı ve [Zn+2] azaltılmalıdır. Bu etki Le Chatelier ilkesine göre dengeyi sağa kaydırır. Dengeyi sağa kaydıran etkiler pil potansiyelini artırır. Bir redoks tepkimesinin 25°C deki farklı derişimlerdeki pil potansiyeli (Epil) ile standart koşullardaki pil potansiyeli arasındaki ilişki Alman termodinamikçi W. Nernst tarafından bulunmuştur. Nernst denklemine göre
Epil = E0pil - (0,0592/n).log([A+]a/[B+]b)
standart koşullarda olmayan pilin potansiyeli hesaplanabilir. (n: Yarı hücre tepkimesinde alınan ya da verilen elektron sayısı)
Sıcaklık Etkisi:
Pil tepkimeleri dışarıya enerji verdiklerinden ekzotermiktir. Buna göre; Sıcaklık artırılırsa, denge sola kayar, pil gerilimi azalır.
Basınç Etkisi:
Basıncın pil gerilimine etkisi ancak gaz elektrotlarda gözlenir. Pilinde H2 basıncının artırılması, dengenin sola kaymasını sağlar ve böylelikle pil gerilimi azalır.
Elektrot Yüzey Alanı Etkisi:
Elektrotların yüzey alanını değiştirmek, pil gerilimini etkilemez.
X(k) + Y+(suda) = X+(suda) + Y(k) denge tepkimesinde Le Chatelier ilkesine göre
•X(k) miktarının artırılması dengeyi etkilemez.
• [Y+ ] derişiminin artın İması dengeyi sağa kaydırır.
• [X+ ] derişiminin artın İması dengeyi sola kaydırır.
• Y(k) miktarının artırılması dengeyi etkilemez.
• Pil tepkimeleri her zaman ekzotermik olduğundan sıcaklık arttırılırsa denge sola kayar.
Epil = E0pil - (0,0592/n) . logKc
Kc = [ürünler] / [girenler]
Epil : 25°C de farklı derişimdeki pil gerilimi
E0pil : 25°C de standart koşullardaki pil gerilimi pil
Kc : derişime bağlı denge sabiti
n: yarı hücre tepkimesindeki alınan ya da verilen elektron sayısı.
Suyun Elektrolizi
Saf suyun 1 atm basınç ve 25°C sıcaklık koşullarında H2(g) ve 02(g) şeklinde bileşenlerine ayrılması kendiliğinden gerçekleşmez, istemsizdir.
Suyun elektrolizi işleminde Hoffman voltametresi kullanılır. Saf suyun elektrolizi çok yavaş gerçekleştiğinden, tepkimeyi hızlandırmak için H2SO4, NaOH gibi iyon oluşturarak elektrik iletkenliğini artıran, ancak değişime uğramayan çözeltiler kullanılabilir. Saf suyun elektrolizinde anot ve katotta gerçekleşen tepkimeler aşağıdaki gibidir.
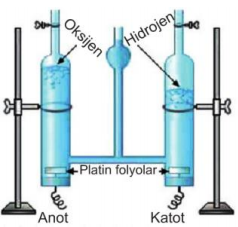
Anot: 2H2O(s) → O2(g) + 4H+(suda)+ 4e- E0= -1,23 V
Katot: 4H+(suda) + 4e- → 2H2(g) E0= 0 V
Toplam: 2H2O(s) → 2H2(g) + O2(g) E0= -1,23 V
Görüldüğü gibi saf suyun elektrolizi sonucunda elde edilen hidrojen ve oksijen gazlarının hacimleri birbirine eşit değildir. Görüldüğü gibi saf suyun elektrolizi sonucunda elde edilen hidrojen ve oksijen gazlarının hacimleri birbirine eşit değildir.
VH2 = 2 . VO2 (V: Hacim)
Sulu Çözeltilerin Elektrolizi
Sulu çözeltilere elektroliz uygulandığı zaman ortamda tuzdan gelen iyonların yanı sıra çözücü olan suda yükseltgenme ve indirgenme de yer alır. Genel olarak ortamda bulunan maddelerden indirgenme gerilimi yüksek olan katotta, yükseltgenme gerilimi büyük olan madde ise anotta açığa çıkar. Sulu NaCI çözeltisini ele alırsak
Katotta:
2Na+(suda) + 2e-→2Na E0= -2,71 V
2H2O + 2e- → H2 + 2OH- E0= -0,83 V
Anotta ise :
2Cl-(suda) →Cl2 + 2e- E0= -1,36 V
2H2O → O2 + 4H+ + 4e- E0= -1,23 V
tepkimelerinin gerçekleşmesi olasıdır.
Yükseltgenme ve indirgenme gerilimlerine bakarsak katotta, H2 gazı ve anotta O2 gazı açığa çıkması gerekir. Ancak endüstriyel uygulamalarda anotta O2 yerine genelde Cl2 gazı açığa çıkar. Bunun birkaç nedeni vardır. Genellikle çözeltiler derişik olduğundan Cliyon derişimi fazla olur. Ayrıca endüstriyel uygulamalarda elektrot direncinin önüne geçmek için yüksek voltaj uygulanır. O halde Naci'nin sulu çözeltisinde katotta H2 elde edilirken anotta Cl2 açığa çıkar.
Elektroliz sırasında maddelerin yükseltgenme ve indirgenme gerilimleri verilmediği zaman, aşağıda verilen kurallara göre anot ve katot tepkimeleri belirlenir :
1. Anot ve katotta pasif element önce açığa çıkar. (Aktiflik metallerde e- verme, ametallerde ise e- almalıdır.)
2. Poliatomik iyonlar (NO3- , SO4-2 PO4-3 ) yükseltgenmezler. Bunların yerine O2 gazı oluşur.
3. F - iyonu hiç bir zaman yükseltgenmez. Onun yerine O2 gazı oluşur.
4. Sulu çözeltilerde I- , Br- , Cl iyonları varsa öncelikle bunlar açığa çıkar.
5. Aktif metaller açığa çıkmazlar. Soy metaller varsa H2 den önce bunlar açığa çıkar, örneğin, Cu, Ag gibi metaller varken Na, K gibi metaller indirgenmezler.
Elektrolizin Nicel İncelenmesi (Faraday Yasası)
Michael Faraday, 1833 yılında elektroliz ile ilgili iki tane yasa belirlemiştir.
Faraday’ın I. elektroliz kanununa göre; Elektrolizde anot ve katotta açığa çıkan madde miktarları devreden geçen elektrik yükü miktarı ile doğru orantılıdır.
Faraday’ın II. elektroliz kanununa göre: "Aynı miktarda elektrik yükü geçen farklı elektrolitlerin elektrolizi sırasında her bir hücre elektrotlarında, elde edilen madde miktarları bu maddelerin eşdeğer kütleleriyle doğru orantılıdır.
Devreden 1 mol elektronun yükü geçince 1 eşdeğer gram madde açığa çıkar. Bir maddenin atom kütlesinin değerliğine oranı eşdeğer kütleyi verir. 1 mol elektronun yükü 1 faradaylık yüktür ve 96500 coulomb elektrik yüküdür.
1 mol elektron = 1F=96500 coulomb
Q=l.t Eşitliği kullanılarak da devreden geçen toplam elektrik yük miktarı bulunabilir.
Q: yük miktarı, birimi coulomb
I: akım şiddeti, birimi amper
t: zaman, birimi saniye