Endüstriyel Elektroliz Uygulamaları
Elektroliz endüstride birçok alanda kullanılır. Bunlardan öne çıkanlar, korozyon, kaplamacılık, metallerin saflaştırılması ve elementlerin eldesi olarak ifade edilebilir. Korozyon Elektrokimyasal işlemler sonucu metallerin aşınmasına korozyon denir.
Demirin paslanması, gümüşün kararması korozyona örnektir. Demirin paslanmasında hem yükseltgenme hem de indirgenmenin olması için ortamda oksijen ve suyun bulunması gerekir.
Demirin bir kısmı anot olarak davranır ve bu bölümde Fe(k) → Fe+2(suda) + 2e tepkimesi gerçekleşir. Metalin diğer bir kısmında ise havadaki oksijen indirgenir, bu bölümde katot olarak ifade edilir.
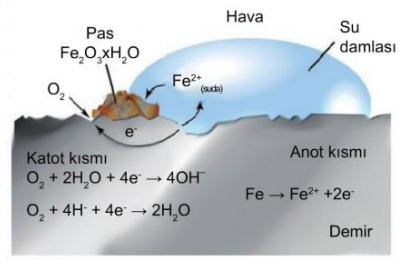
Oluşan Fe+2 iyonu asidik ortamda tekrar oksijen ile tepkime vererek Fe2O3 (pas) oluşturur. Korozyonun önlenebilmesi için, metalin nemden ve oksijenden uzak tutulması gerekir. Bunun için genellikle metaller boyanır. Boru hattı yeraltı su ve yakıt depoları gibi sistemlerde korozyonun önlenmesi için daha aktif bir elektrot kurban elektrot olarak kullanılır. Bu sayede demir yerine sisteme bağlanan Mg gibi kurban elektrotlar aşınır.
Kaplamacılık :
Metalleri korozyandan korumak ve iyi bir görünüme sahip olmalarını sağlamak için metallerin yüzeyi korozyona dayanıklı başka bir metal ile kaplanabilir.
Kapalama yapılacak metal katot olarak, kaplama yapılacak metalin çözeltisi içerisine daldırılır. Anot olarak genelde çözeltideki kaplama için kullanılan iyonun metali kullanılır.
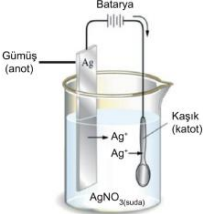
Şekilde bir kaşık nikel ile kaplanmaktadır. Katotta metal +2 kaşık, anotta nikel metal vardır ve Ni çözeltisi içerisine anot ve katot yerleştirilmiştir. Kapı kolları, musluk ve bataryalar, birçok araba aksesuarı korozyana karşı nikel, krom gibi metallerle kaplanır.
Metalin ne kadar kaplanacağı devreden geçen akımın ve sürenin ayarlanması ile sağlanır. Ayrıca kaplamanın homojen olması ve yüzeyde yanık oluşmaması için çözelti veya kaplanacak parça işlem boyunca hareket ettirilir.
Metallerin Saflaştırılması:
Bakır gibi metaller elde edildiklerinde genellikle çinko, demir gibi bazı metalleri barındırırlar. Safsızlığa neden olan bu metaller elektroliz ile ayrıştırılır. Şekildeki düzenekte bakırın saflık derecesi %99,5 üzerine kadar çıkarılır. Burada anotta saf olmayan külçe ayrışırken katotta saf bakır toplanır.
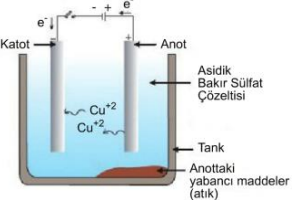
Anot: Cu(k) → Cu+2(suda) + 2e-
Katot: Cu+2(suda) + 2e- → Cu+2(k)
Safsızlığa neden olan Fe, Zn, Au, Ag gibi maddeler Cu iyonuna göre daha zor indirgendiğinden çözelti içerisinde iyon olarak veya elektrot üzerinde metal olarak kalırlar.
Metal Eldesi :
Alüminyum gibi bazı elementler cevherlerinden elde edilirken öncelikle çözeltide iyon halinde elde edilirler. Bu iyonların katı metale dönüşmesi için uygun koşullarda indirgenmesi gerekir. Bunun için de elektroliz işlemi uygulanır.
Örneğin alüminyum eldesi sırasında çözelti elektroliz edilirse
Anot: 2O-2 → O2 + 4e-
Katot: Al+3(suda) + 3e- → Al
tepkimesi sonucu alüminyum metali ve oksijen gazı elde edilir. Elde edilen alüminyum miktarı devreden geçen akımla doğru orantılıdır.
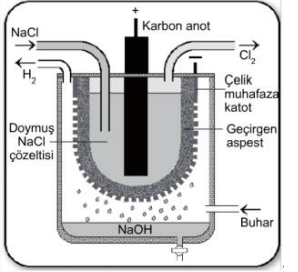
Metal eldesi, saflaştırılması, sudan hidrojen eldesi yanı sıra önemli bir elektroliz uygulaması da endüstriyel NaOH üretimidir. NaOH üretimi gerçekte sulu NaCI çözeltisinin özel bir elektroliz kabında elektrolizinden başka bir şey değildir. Bu sistemde anotta Cl2 gazı ve katotta H2 gazı açığa çıkarken NaOH çözeltisi başka bir kaba alınarak buharlaştırılır. Böylece katı NaOH elde edilir.
Kuru Pil, Akümülatör Ve Lityum Pilleri :
Sulu çözeltiler yerine farklı maddeler kullanılarak elde edilen pillere kuru piller denir. En çok bilinen kuru pil Leclanche pili de denen çinko pilidir.
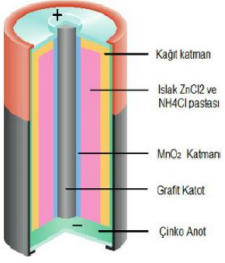
Anot: Zn(s) → Zn+2(aq) + 2e-
Katot: 2NH+4(suda) + 2MnO2(s) + 2e- → Mn2O3(s) + 2NH3(suda) + H2O(/)
Zn(s) + 2NH+4(suda) + 2MnO2(s) → Zn+2(suda) + 2NH3(suda) + H2O(/) + Mn2O3(s)
Bu pillerden sonra bazik ortamda tepkimelerin gerçekleştiği bu nedenle de alkali pil denen pillerin kullanımı yoğunlaşmıştır, alkali pillerin anodunda çinko tozu, katodunda ise mangan dioksit (MnO2) bulunmaktadır. Elektroliti pelteleştirmek için bir selüloz türevi kullanılır.
Elektrolit, potasyum hidroksittir. Alkali piller, aktif katot maddesi olarak civa oksit (HgO) veya gümüş oksit (Ag2O) gibi maddeleri de kullanılır. Bu pillerde tepkimeler tersinir olmadığından, piller şarj edilemez. Pillerin şarj edilmesi için tepkimelerin tersinir olması gerekir.
Aküler :
Akümülatörlerde birbirine seri bağlı 6 tane hücre bulunur. Her hücre 2 volt gerilim üretir. Plakalar arasında elektrolit olarak derişik sülfürik asit çözeltisi kullanılır. Bir akümülatördeki negatif plakaların sayısı pozitif plakaların sayısından bir fazladır. Plakalardaki aktif madde kurşun-antimon alaşımından yapılan ızgara şeklindeki kafeslere doldurulur. Dolu aküyü kullandıkça deşarj başlar.
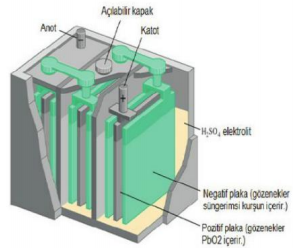
Anot: Pb(s) + SO4(suda) → PbSO4 + 2e-
Katot: PbO2(s) + 4H+(suda) + SO24(suda) + 2e- → PbSO4(s)+ 2H2O(/)
Pb(s) + PbO2(s) + 4H+(suda) + SO24(suda) → 2PbSO4(s) + 2H2O(/)
Deşarj sırasında çözeltideki sülfat iyonu negatif yükünü kurşun levhaya vererek kurşunla birleşir ve kurşun sülfat (PbSO4) meydana gelir. Diğer yanda ise yine sülfat iyonu Kurşun (IV) oksit ile etkileşime girerek kurşun sülfat ve su oluşturur. Böylece her iki plakada kurşun sülfata dönüşür. Akü dış devreye akım vermeye her iki levha kurşun sülfata dönüşünceye kadar devam eder. Her iki plakada tamamen kurşun sülfata dönüşünce, levhalar arası potansiyel farkı sıfır olur ve akü biter.
Akünün deşarj olması sırasında:
1. Elektrolitteki asit yoğunluğu zayıflar. Bu akü potansiyelini düşürür.
2. Plakaların aktif maddeleri, kurşun (IV) oksit ve kurşun, kurşun sülfata dönüşürler.
3. Akü boşaldıkça akünün iç direnci büyür, potansiyeli düşer. Akünün dolması (şarj olması) sırasında ise anot ve katot tepkimeleri ters yönde gerçekleşir ve yukarıda belirtilen süreç ters yönde ilerler.
Lityum İyon Pilleri (Li-ION):
Lityum iyon pilin temel ilkesi şudur: Dolma ve boşalma işlemi, temelde yalnızca lityum iyonların iki elektrot arasındaki transferi aracılığıyla gerçekleşir. Pil dolarken lityum iyonlar karbondan yapılmış grafit bir katmana transfer edilir. Boşalma sırasında iyonlar geri gider. İyonların geçişi elektron akışını kontrol eden elektromanyetik bir güç yaratır.
Lityum iyon pillerde, artı uç lityum metal oksitten ve eksi uç karbondan yapılmıştır. Bu piller aynı zamanda bir elektronik devre içerir. Böylece pillerin ne kadarının dolu olduğu ne kadarının boş olduğu kaydı sürekli tutulduğundan tamamen boşalmadan da bu piller tekrar şarj edilebilir. Ancak pilin kullanım ömrü üretim tarihinden itibaren başlar. Li-ion piller hafiftir. Cep telefonları, tabletler ve bilgisayarların çoğunluğu artık li-ion pil kullanılmaktadır.
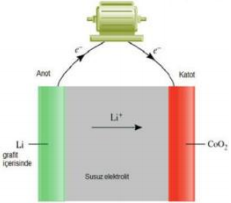
Anot: Li → Li+ + e-
Katot: Li+ + CoO2 + e- → LiCoO2