Elektrokimyasal Piller:
Elektrokimyasal piller, kendiliğinden gerçekleşen redoks tepkimeleriyle elektrik enerjisi üreten sistemlerdir. Galvanik ya da Volta pilleri olarak da adlandırılırlar.
Anyon: (-) yüklü iyonlardır.
Katyon: (+) yüklü iyonlardır.
Elektrot: Yükseltgenme ya da indirgenmenin gerçekleştiği tel ya da levha halinde olan metal parçasıdır.
Elektrolit: Elektrotun içine daldırıldığı sıvıdır. Anot: Yükseltgenmenin gerçekleştiği elektrottur.
Katot: İndirgenmenin gerçekleştiği elektrottur.
Standart Yarı Piller: Eğer bir yarı pil, 25 °C ve 1 atm basınç altında 1 M lık iyon çözeltisine daldırılmış bir metal elektrot içeriyorsa, bu tür yarı pillere standart yarı pil denir.
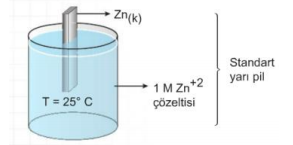
Böyle bir pil sisteminde;
Zn(k) = Zn(suda)+2 + 2e- dengesi vardır.
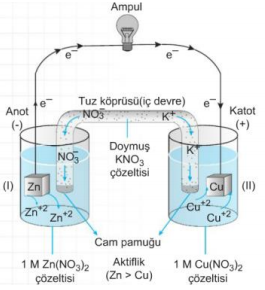
Bir Elektrokimyasal Pilin Çalışma prensibi yukarda verilmiştir.
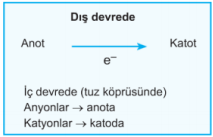
a. Eğer iki yarı pilin elektrotları, küçük bir ampulden geçen metal bir iletken ile birleştirilirse, yarı pillerdeki denge bozulmuş olur.
b. Elektrotları birbirine bağlayan devreye dış devre denir.
* Zn metali Cu metalinden daha aktif olduğundan, tepkimeleri gerçekleşir. Çinko ve bakır elektrot ve bunların çözeltilerinin kullanıldığı pile aynı zamanda Daniell pili de denir.
c. Yükseltgenme anotta gerçekleşir.
d. İndirgenme katotta gerçekleşir.
e. Anotta elektronlar üretildiği için anot (-) yüklüdür.
f. Katot ise (+) yüklüdür. Dış devrede elektronlar anottan katoda doğru hareket ederler (- den + ya)
g. Yalnızca dış devre ile pil çalışmaz, devrenin tamamlanması gerekir. Bu nedenle tuz köprüsü kullanılır.
h. Tuz köprüsü elektriksel nötrallığı sağlayarak devreyi tamamlar ve pilin çalışmasını sağlar.
i. Pil çalışırken, anotta Zn katısının kütlesi azalır, Zn iyon derişimi artar. Görüldüğü gibi anotta (+) yük yoğunluğu artacağından nötralliği sağlamak için tuz köprüsündeki (-) yüklü iyonlar (anyonlar) anot bölümüne geçer.
j. Katotta Cu+2 iyonları elektronları alarak indirgendiklerinden II nolu kapta Cu kütlesi artar. Cu+2 derişimi azalır. Nötralliği sağlamak için tuz köprüsündeki (+) yüklü iyonlar (katyonlar) katoda geçerler. k. Tuz köprüsündeki anyonlar -» anoda, katyonlar → katoda geçerler.
l. Tuz köprüsündeki bu iyon hareketleri iç devre olarak adlandırılır.
Anot tepkimesi solda gösterilir. Katot tepkimesi sağda gösterilir. Tuz köprüsü || işareti ile gösterilir. Kısaca özetlerse
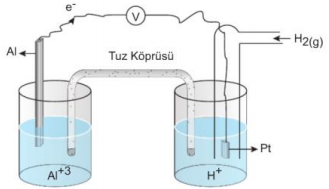
Yukarıda gösterimi verilen pili çizerek anot ve katot bölümlerini ve buralarda gerçekleşen tepkimeleri yazınız. Dış devreden geçen elektron yönünü gösteriniz. Pili çizmeden önce gösterimden sol tarafın anot sağ tarafın katot olduğunu hatırlayalım. Anotta yükseltgenme tepkimesi yani Al(k) → Al+3(suda) +3e- ve katotta indirgenme yani tepkesi 2H+ (suda) +2e- → H2(g) gerçekleşir.
Al → Al+3 + 3e tepkimesinde e- açığa çıkarak bu elektronlar H+ iyonunun H2(g) gazına indirgenmesini sağlar. Bu nedenle elektronlar dış devrede anottan katoda doğru gider.
Aşağıdaki örneklerle öğrendiklerimizi pekiştirelim.
Al(k) | Al+3(suda) | H+(suda) | H2(g) (Pt)
STANDART ELEKTROT POTANSİYELLERİ
Bir pilin voltajı ya da gerilimi, iki yan pil tepkimesinin elektron verme eğilimleri arasındaki farktır. Bir pilin gerilimi basınç, sıcaklık ve çözeltilerin derişimlerine bağlıdır. Pil gerilimleri 25 °C ve 1 atm basınçta, iyon derişimi 1 Moları çözeltiler kullanılarak ölçülürse, bu gerilimlere standart o pil gerilimleri denir ve E0 pil şeklinde gösterilir.
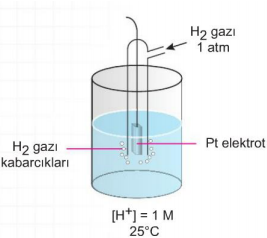
Tek bir yarı pilin gerilimini ölçmek imkansızdır. Bu nedenle seçilen bir yarı pilin standart gerilimi sıfır kabul edilir (referans elektrot) ve diğer yarı pil gerilimleri bu referansla karşılaştırılarak bulunabilir. Bu işlem için seçilen referans yarı pil standart hidrojen elektrotudur. (SHE).
Tepkimeye girmeyen Pt elektrot (katalizör görevi yapar), 1 M H+ derişimine sahip bir asit çözeltisine 25 °C de batırılır, bu çözelti sürekli olarak 1 atm basınçta H2 gazı ile temas halinde tutulur. Buna göre; denge olayı olur. Bu tepkimede H+ iyonunun indirgenme eğilimi ölçülmüş tür. E nin üzerindeki " 0 " standart koşullan belirtir.