1. İYONİK BAĞ
İYONİK BİLEŞİKLERİN LEWİS YAPISI
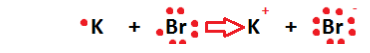
BİLEŞİKLER
BİLEŞİK FORMÜLLERİNİN YAZILMASI:
1. Yükler element sembollerinin sağ alt köşelerine yazılır
A+m x B-n
2-Aynı Yükler yazılmaz.
Ca+2O-2 → .....................................
3- Kökler mutlaka parantez içinde yazılmalıdır.
Al+3 (NO3)-1 → .............................
NOT: CaOH2 yazılımı yanlıştır.
İYONİK BİLEŞİKLERİN ADLANDIRILMASI
1. METAL ADI + AMETAL ADI (7A GRUBU) + ÜR→ BİLEŞİĞİN ADI
Bileşik |
Bileşiğin Adı |
KF |
|
AlBr3 |
|
MgI2 |
|
CaCl2 |
|
2. METAL ADI + AMETAL ÖZEL ADI → BİLEŞİK ADI
Ametal Özel Adı |
|
O-2 |
Oksit |
S-2 |
Sülfür |
N-3 |
Nitrür |
P-3 |
Fosfür |
H-1 |
Hidrür |
BİLEŞİK |
ADLANDIRMA |
Li2O: |
|
SrS |
|
AlP |
|
Mg3N2 |
|
KH |
|
CaS |
|
BeH2 |
|
BaO |
|
3. METAL ADI + ROMA RAKAMI İLE YÜKÜ + AMETAL ÖZEL ADI (AMETAL ADI+ ÜR)→ BİLEŞİK
BİRDEN FAZLA YÜKLÜ METALLER |
Bileşik ADLANDIRMA |
Fe+2,+3 Demir |
FeCl2: |
Hg+1,+2 Civa |
MnN |
Cu+1,+2 Bakır |
HgO |
Pb+2,+4 Kurşun |
PbO2 |
Sn+2,+4 Kalay |
CuSO4 |
Mn+3,+4,+6,+7 Mangan |
SnS |
Cr+3,+6 Krom |
Cr2O3 |
|
|
|
|
4. METAL ADI + KÖK ADI→ BİLEŞİK ADI
BİLEŞİK |
ADLANDIRMA |
CH3COONa: |
|
Al(NO3)3 |
|
CaSO4 |
|
HCOOK |
|
HgNO3 |
|
CrPO4 |
|
5. KÖK ADI + KÖKÜN ADI + AMETAL ÖZEL ADI→ BİLEŞİK ADI
BİLEŞİK |
ADLANDIRMA |
NH4NO3 |
|
NH4Cl |
|
(NH4)2S |
|
(NH4)2SO4 |
|
NH4Br |
|
2. KOVALENT BAĞ
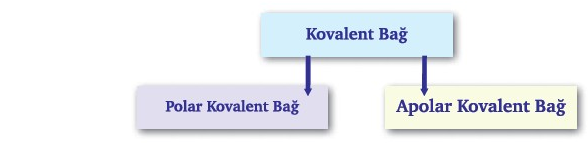
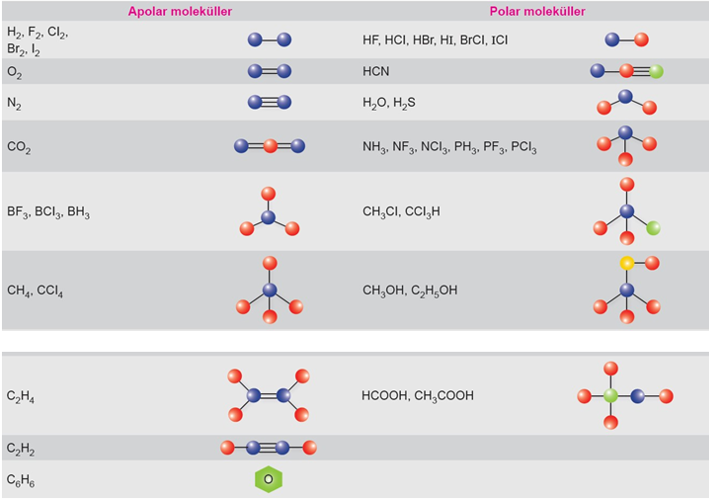
1-İki Atomlu Apolar Kovalent Bağlı Moleküller Lewis Yapısı
a.Tek Bağlı Apolar Kovalent Moleküller
H2, F2, Cl2, Br2……
b.İkili Bağlı Apolar Kovalent Bağlı Moleküller: O2
c.Üçlü Bağlı Apolar Kovalent Bağlı Moleküller: N2
2-İki Atomlu Polar Kovalent Bağlı Moleküller:
HF, HCl, HBr, HI
3-İkiden Fazla Atomlu Molekül Apolar, ağ içi Polar Kovalent Bağlı Moleküller:
CO2, CS2, BF3, BH3, BeH2, BCl3, CH4, CCL4
4- İkiden Fazla Molekül Polar, Bağ İçi Polar Olan Moleküller:
H2O, H2S, NH3, NCl3, NF3, PH3, PCl3, CH3Cl, CH3OH
KOVALENT BİLEŞİKLERİN ADLANDIRILMASI
KURAL
1.AMETALİN LATİNCE SAYISI + 1. AMETAL ADI + 2.AMETALİN LATİNCE SAYISI + 2.AMETAL ADI
Latince Sayılar
Mono: 1Hekza: 6
Di: 2Hepta: 7
Tri: 3Okta: 8
Tetra: 4Nona: 9
Penta: 5Deka: 10
NOT: 1.Ametalden bir tane varsa MONO kullanılmaz.
NOT: Bileşikte metal varsa Mono, di diye okunmaz.
NOT: Bileşiklerinde belli sayıda su molekülü bulunan bileşiklere HİDRAT denir.
CuSO4.5H2O = Bakır(II) Sülfat penta hidrat
Mg(NO3)2.7H2O= Magnezyum nitrat hepta hidrat
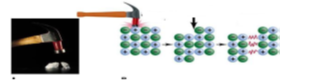
3. METALİK BAĞLAR
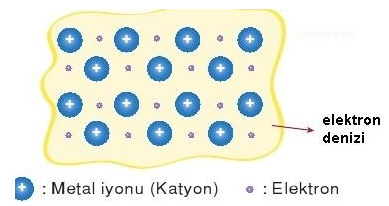
METALLERİN ÖZELLİKLERİ METALİK BAĞ İLİŞKİSİ
1.TEL VE LEVHA HALİNE GETİRİLME
+ Metallere çekiçle vurulduğunda metal atomları elektron denizinde kayar.
2. METALLERİN ELEKTRİK İLETKENLİĞİ
+ Değerlik elektronların serbest hareket etmesi metallere elektrik akımı iletkenliğini kazandırır.
3.METALİK PARLAKLIK
+ metallere çekiçle vurulduğunda metal atomları elektron denizinde kayar.
+ Hangi ışığı yansıtırsa metal o renk görülür.
ZAYIF ETKİLEŞİMLER

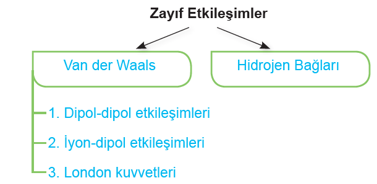
1. Van der Walls Etkileşimleri
A. Dipol Dipol Etkileşimleri
Polar moleküllerin birbirine yakınlaşması ile zıt uçlar birbirini çekerken, aynı yüklü kısımlar birbirini iter.
Polar yapıya sahip tüm kovalent bağlı moleküllerde dipol-dipol etkileşimi bulunur.
Moleküller Arasında Farklı
Moleküller Arasında
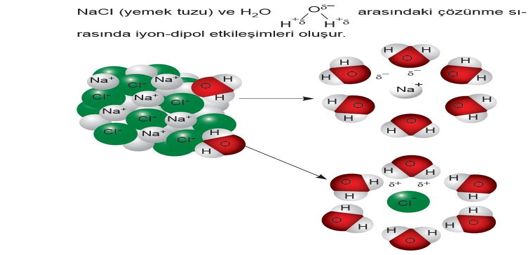
B. İyon - Dipol Etkileşimleri
İyonik katıların su gibi polar çözücülerde çözünmesini sağlayan etkileşim iyon-dipol çekim kuvvetleridir.
Tüm iyonik bağlı bileşiklerin polar moleküller ile etkileşiminde iyon-dipol kuvvetleri bulunur.
İyon ile polar molekülün zıt yüklü uçları arasındaki elektrostatik çekim kuvvetine iyon-dipol etkileşimleri denir.
C. London Kuvvetleri
Apolar moleküller ve asal gaz atomları arasında oluşan çekim kuvvetleridir.
Apolar moleküllerdeki tanecikler üzerinde sürekli pozitif veya sürekli negatif olan belirli bir kısım yoktur.
London Kuvvetleri
– Elektron sayısı arttıkça
– molekül / atom kütlesi arttıkça
– molekül üzerindeki temas yüzeyi arttıkça artar.
Örneğin soygazlarda 2He, 10Ne, 18Ar, 36Kr, 54Xe, 86Rn atom numarası yeni elektron sayısı arttıkça anlık polarlanma artacağından grupta aşağı doğru inerken atomun erime ve kaynama noktası artar.
| Atom | Elektron Sayısı | Kaynama Noktası (oC) |
| He | 2 | -269 |
| Ne | 10 | -246 |
| Ar | 18 | -186 |
| Kr | 36 | -152 |
| Xe | 54 | -107 |
| Rn | 86 | -62 |
| Molekül | Toplam e- sayısı | Kaynama Noktası (oC) |
| F2 | 18 | -188 |
| Cl2 | 34 | -34 |
| Br2 | 70 | 59 |
| I2 | 106 | 184 |
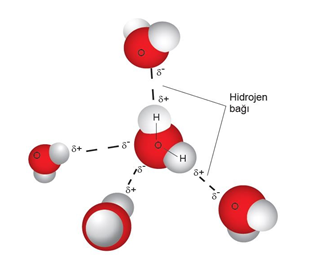
HİDROJEN BAĞI
Hidrojen atomunun elektronegatifliği çok yüksek olan F, O veya N atomuna kovalent bağla bağlanmasıyla oluşan moleküller arasındaki çekim kuvvetine hidrojen bağı denir.
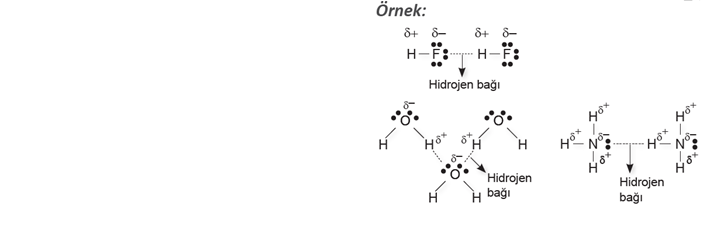
Hidrojen bağı aynı tür moleküller arasında oluşabileceği gibi farklı tür moleküller arasında da oluşur.
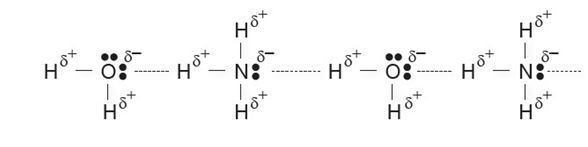
Hidrojen bağı zayıf etkileşimler arasında daha güçlü olanıdır.
Suyun özel durumu:
GÜÇLÜ BAĞLAR
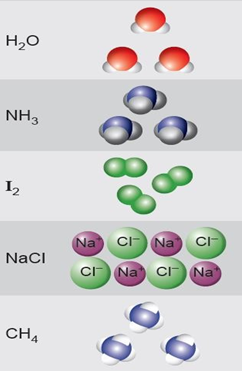
ZAYIF BAĞLAR