ÇÖZELTİLERDE DERİŞİM
Derişim bir çözeltide bulunan çözünen madde miktarının ölçüsüdür. Derişim değişik birimlerde kullanılabilir. Bu ünitede yüzde derişim çeşitleri ve ppm derişim birimlerinden bahsedilecektir.
Yüzde derişim:
Kütlece Yüzde Derişim: Bir çözeltinin 100 gramındaki çözünen maddenin gram cinsinden değerine kütlece yüzde derişim denir.
Örneğin; 20 g şeker ve 80 g sudan oluşan bir çözelti 100 g’dır. Çözücü ve çözünenin toplamı çözelti kütlesini verir. 100 g çözelti 20 g şeker içerdiği için çözelti % 20’lik şeker çözeltisidir.

Kütlece yüzde derişimi farklı olan çözeltilerin karıştırılması:

Bir çözeltinin 100 hacim biriminde (mL, L, m3, dm3, vb.) çözünen maddenin hacim birimine hacimce yüzde derişim denir.

Kütle - Hacimce Yüzde Derişim: Katı ve sıvıdan oluşan çözeltilerde genellikle bu derişim birimi kullanılmaktadır. 100 hacim birimi çözeltide çözünen maddenin kütlesi olarak tanımlanır.

Milyonda Bir Kısım (ppm): 1 000 000 g ( 1 ton) çözeltide çözünen 1 g maddeyi ifade eden derişim birimidir. Çözeltinin derişimini ifade ederken büyük rakamları kullanmak yerine milyonda bir kısım (ppm) şeklinde ifade edilir.
Örneğin, havanın karbondioksit oranı 350 ppm dediğimizde;
1 ton havada 350 g karbondioksit olduğunu ifade etmiş oluruz.
KOLİGATİF (DERİŞİME BAĞLI) ÖZELLİKLER
Çözeltilerin saf maddeler gibi belirli kaynama ve donma noktası yoktur. Çözelti içindeki çözünen miktarı, yani çözeltinin derişimi karışımın kaynama ve donma noktasını değiştirir. Derişimle birlikte değişen bu özelliklere koligatif özellikler denir.
Kaynama Noktası Yükselmesi: Uçucu olmayan maddelerin tuz, şeker vb. gibi çözeltilerinin kaynamaya başlama sıcaklığı daima saf çözücününkinden yüksektir. Bu olaya kaynama noktası yükselmesi denir. Tuz eklenen yemeğin daha geç kaynaması bu mantığa dayanır.
Donma Noktası Alçalması: Uçucu olmayan katılardan oluşan tüm çözeltilerde çözeltinin donmaya başlama sıcaklığı saf çözücününkinden daha düşüktür. Bu olaya donma noktası alçalması denir. Günlük hayatta karlı günlerde yolların buz tutmaması için tuzlanması, arabaların radyatörlerine glikol eklenmesi bu mantığa dayanır.
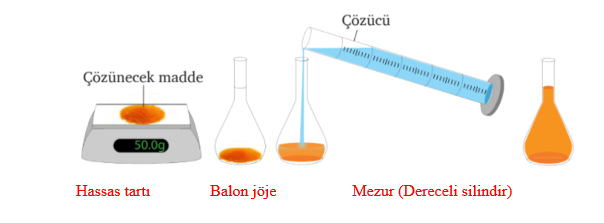
Çözelti Hazırlama:
Laboratuvarda kullanılan en yaygın uygulamalardan biri istenilen derişimde çözeltiler hazırlamaktır. Bu işlem için terazi, pipet, beher, erlenmayer, balon joje, dereceli silindir, baget gibi malzemeler kullanılır. Çözelti hazırlanırken aşağıdaki aşamalar izlenir:
• Çözücü ve çözünenin ambalajından yoğunluk, ağırlıkça yüzde, molekül ağırlığı gibi etiket bilgileri incelenir.
• İstenen derişime uygun miktarda çözünen ve çözücü madde miktarı hesaplanır.
• Hesaplanan miktarda çözünen madde tartılır.
• Tartımı alınan çözünen madde balon joje veya beher gibi ölçülü bir kaba aktarılır.
• Çözünen madde önce bir miktar saf çözücü ile çözünür.
• Balon joje ölçü çizgisine kadar çözücü ile doldurulur