KARIŞIMLAR
Karışımların Sınıflandırılması
Birden fazla maddenin kimyasal özellikleri değişmeden bir araya gelmesiyle oluşan sistemlere karışım denir.
Karışımlar homojen ve heterojen olmak üzere iki gruba ayrılır.
1.Homojen Karışımlar (Çözeltiler): Her yerinde aynı özelliği gösteren karışımlara homojen karışım denir. Homojen karışımlar bir maddenin başka bir madde içinde çözünmesi ile oluşur. Bu nedenle homojen karışımlara çözelti denir.
Çözeltiler çözücü ve çözünenden oluşur.
Çözücü: Genellikle miktarı fazla olan madde çözücüdür. Su her zaman çözücü sayılır.
Çözünen: Genellikle miktarı az olan madde çözünendir.
Çözünme Şekline Göre Çözelti Çeşitleri Moleküllü Çözelti:
Moleküllü Çözelti: Maddenin çözücü içinde molekül halinde homojen dağılması ile oluşan çözeltiler. Kovalent bileşikler genellikle moleküler çözünme gösterir.
ÖR: C2H5OH, C12H22O11
İyonik Çözelti: Maddenin çözücü içinde iyonlarına ayrışarak homojen dağılmasıdır. İyonik bileşikler iyonik çözünme gösterir.
ÖR: NaCl, Ca(NO3)2...
İyonik çözeltiler elektriği iletir, bunlara elektrolit çözelti denir. Moleküllü çözeltiler ise elektriği iletmez, bunlara elektrolit olmayan çözeltiler denir.
Çözünen Madde Miktarına Göre Çözelti Çeşitleri Doymuş Çözelti: Belirli sıcaklıkta çözebileceği maksimum miktarda maddeyi çözmüş çözeltilerdir.
Doymamış Çözelti: Belirli sıcaklıkta çözebileceği maksimum miktardan daha az çözünen içeren çözeltilerdir.
Aşırı Doymuş Çözelti: Belirli sıcaklıkta çözebileceği maksimum miktardan daha fazla çözünen içeren çözeltilerdir. Aşırı doymuş çözeltiler kararsızdır. Bir dış etki ile çözünen fazla madde çöker.
Çözünen/Çözücü Oranına Göre Çözelti Çeşitleri
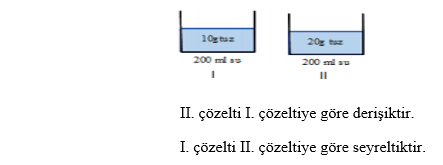
Derişik Çözelti: Çözünen miktarı görece fazla olan çözeltilerdir.
Seyreltik Çözelti: Çözünen miktarı görece az olan çözeltilerdir.
ÇÖZÜNME OLAYI
Hidrasyon ve Solvasyon Bir maddenin suda çözünmesi olayına hidrasyon (hidratasyon), sudan farklı bir çözücüde çözünmesi olayına solvasyon (solvatasyon) adı verilir.
Polarlığın Çözünmedeki Rolü Benzer benzeri çözer ilkesi: Polar maddeler polar çözücülerde, apolar maddeler apolar çözücülerde iyi çözünür. Bir molekülün polarlığı arttıkça çözünme miktarı artar. İyonik katılar polar çözücülerde iyi çözünür.
CCl4, CH4, C2H6, C6H6, CO2, I2 gibi maddeler apolar moleküllerdir. Bu maddelerin biribiri içinde iyi çözünmesi beklenir.
H2O (su), CHCl3 (kloroform), H2S, HF, C2H5OH (etil alkol), gibi maddeler polar moleküllerdir. Bu maddelerin birbiri içinde iyi çözünmesi beklenir.
NaCl, NaOH, Na2CO3 gibi maddeler iyonik katıdırlar ve polar çözücülerde iyi çözünürler.
CCl4 - H2O, C6H6 - CHCl3 gibi ikili karışımlarda moleküller birbirini iyi çözmez.
Çözünme Olayı ve Kimyasal Değişim
İyonik katılar, asitler, O2 gazı ve çoğu kovalent bileşik suda fiziksel yolla çözünürken, CO2 gazı ve Na, K gibi aktif metaller suda kimyasal yolla çözünür.
Ca(NO3)2(k) → Ca2+ + 2NO- 3(suda) (fiziksel çözünme)
CO2 + H2O → H2CO3 → HCO-3 + H+ (kimyasal çözünme)
Na + H2O → NaOH + H2
(kimyasal çözünme)
2. Heterojen Karışımlar
Her yerinde aynı özelliği göstermeyen karışımlara heterojen karışımlar denir.
Adi Karışım: Dağılan ve dağıtıcı faz ayrımı yapılmayan karışımlardır.
ÖR: Karışık çerez, salata gibi.
Süspansiyon (sol): Bir sıvı içinde, katının tanecik boyutu m den büyük olacak şekilde dağılmasıyla oluşan heterojen karışımlardır. Tanecik boyutu 0,1 mm ya da daha büyükse kaba süspansiyon, 0,1 mm den daha küçükse kolloidal süspansiyon adını alır.
ÖR: (Kaba süspansiyon): Çamurlu su, tebeşir tozu ve ayran
ÖR: (Kolloidal süspansiyon): Peynir suyu, yumurta akı, kan, yağlı boya
Emülsiyon: Bir sıvı içinde, başka bir sıvının heterojen dağılmasıyla oluşan heterojen karışımlara emülsiyon adı verilir.
ÖR: (Kaba emülsiyon): Su-zeytinyağı, su-karbontetraklorür (CCl4)
ÖR: (Kolloidal süspansiyon): Mayonez, süt.
Aerosol: Bir gaz içinde sıvı ya da katının heterojen dağılmasıyla oluşan karışımlara aerosol adı verilir.
ÖR: Sis, bulut, tozlu hava, kirli hava, duman, sprey boya, deodorant, sabun köpüğü, süslü camlar, jel, strafor.
Çözelti - kolloid - süspansiyon arasındaki fark:
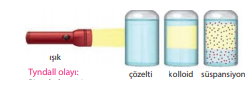
Dağılan fazın tanecik boyutu:
Bir ışık demeti karışımın üzerine gönderildiğinde gözle görülmeyen kolloid taneciklerin ışığı yansıtması sonucu görülmesi olayı. Bu olayla kolloid karışımlar ayırt edilir.
ÇÖZELTİLERDE DERİŞİM
Derişim bir çözeltide bulunan çözünen madde miktarının ölçüsüdür.
Derişim değişik birimlerde kullanılabilir. Bu ünitede yüzde derişim çeşitleri ve ppm derişim birimlerinden bahsedilecektir.
Yüzde derişim:
Kütlece Yüzde Derişim:
Bir çözeltinin 100 gramındaki çözünen maddenin gram cinsinden değerine kütlece yüzde derişim denir.
Örneğin; 20 g şeker ve 80 g sudan oluşan bir çözelti 100 g’dır. Çözücü ve çözünenin toplamı çözelti kütlesini verir. 100 g çözelti 20 g şeker içerdiği için çözelti % 20’lik şeker çözeltisidir.
Kütlece Yüzde Derişim = (Çözünen Kütlesi / Çözelti Kütlesi) . 100
Kütlece yüzde derişimi farklı olan çözeltilerin karıştırılması:
m1 . C1 + m2 . C2 = mtoplam x Cson eşitliği kullanılır.
m1: 1. çözeltinin kütlesi m2: 2. çözeltinin kütlesi
C1: 1. çözeltinin yüzde derişimi C2: 2. çözeltinin yüzde derişimi
Seyreltme işlemi: Seyreltme işlemi yapılırken eklenen saf sıvının (bu genelde su olur) yüzdesi sıfır alınır.
Deriştirme işlemi: Deriştirme işlemi yapılırken eklenen saf katının derişimi yüzde yüz alınır.
Hacimce Yüzde Derişim:
Sıvılardan oluşan çözeltilerde derişim belirtilirken kütle yerine hacim değerleri de kullanılabilir.
Bir çözeltinin 100 hacim biriminde (mL, L, m3, dm3, vb.) çözünen maddenin hacim birimine hacimce yüzde derişim denir.
Hacimce Yüzde Derişim = (Çözünenin Hacmi / Çözelti Hacmi) . 100
Kütle - Hacimce Yüzde Derişim:
Katı ve sıvıdan oluşan çözeltilerde genellikle bu derişim birimi kullanılmaktadır. 100 hacim birimi çözeltide çözünen maddenin kütlesi olarak tanımlanır.
Ağırlık hacim yüzdesi = (Çözünenin Kütlesi / Çözelti Hacmi) . 100
Milyonda Bir Kısım (ppm):
1 000 000 g ( 1 ton) çözeltide çözünen 1 g maddeyi ifade eden derişim birimidir. Çözeltinin derişimini ifade ederken büyük rakamları kullanmak yerine milyonda bir kısım (ppm) şeklinde ifade edilir.
Örneğin, havanın karbondioksit oranı 350 ppm dediğimizde;
1 ton havada 350 g karbondioksit olduğunu ifade etmiş oluruz.
KOLİGATİF (DERİŞİME BAĞLI) ÖZELLİKLER
Çözeltilerin saf maddeler gibi belirli kaynama ve donma noktası yoktur. Çözelti içindeki çözünen miktarı, yani çözeltinin derişimi karışımın kaynama ve donma noktasını değiştirir.
Derişimle birlikte değişen bu özelliklere koligatif özellikler denir.
Kaynama Noktası Yükselmesi:
Uçucu olmayan maddelerin tuz, şeker vb. gibi çözeltilerinin kaynamaya başlama sıcaklığı daima saf çözücününkinden yüksektir. Bu olaya kaynama noktası yükselmesi denir.
Donma Noktası Alçalması:
Uçucu olmayan katılardan oluşan tüm çözeltilerde çözeltinin donmaya başlama sıcaklığı saf çözücününkinden daha düşüktür. Bu olaya donma noktası alçalması denir.
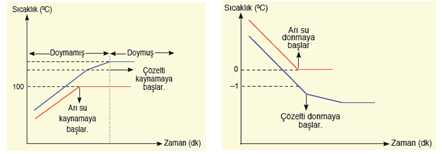
1 atm'de saf su ve çözeltisinin kaynama eğrileri 1 atm'de saf su ve çözeltisinin donma eğrileri
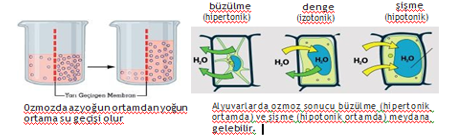
Ozmoz:
Ozmoz, çözücü moleküllerinin yarı geçirgen zardan geçerek daha derişik çözeltiye akması olayıdır. Yarı geçirgen zar sadece belirli büyüklükteki molekül ve iyonların geçişine izin verir.
Su molekülleri şeker moleküllerinden daha küçük olduğu için yarı geçirgen zardan geçerek cam boruda sıvı seviyesinin artışına neden olur. Bu artış ile cam boruda yükselen sıvı hidrostatik basınç yapmaya başlar. Hidrostatik basınç, sulu çözelti ya da su dolu bir kolonun yaptığı basınç olarak tanımlanır. Cam borudaki hidrostatik basınç ozmoza karşı gelerek onu durdurur. Bu nedenle bu basınca ozmotik basınç denir.
KARIŞIMLARIN AYRILMASI
1.Tanecik Boyutu Farkı İle Ayırma Yöntemleri
Eleme: Tanecik boyutu çok büyük katı-katı karışımlar. Çakıl-kum.
Ayıklama: Tanecik boyutu büyük katı-katı karışımlar. Pirinçten taşın ayıklanması. Mıknatısla ayıklama: Demir, nikel veya kobalt içeren karışımların mıknatısla ayıklanması işlemi. Demir, nikel ve kobalt mıknatıstan etkilendiği için karışımdan kolayca ayrılırlar.
Süzme: Katı-sıvı ve katı-gaz heterojen karışımlara uygulanır. Süzme işlemi için süzgeç kullanılır. Tozlu havadan tozun ayrılması, su arıtımında suyun kirden arındırılması.
Diyaliz: Katı-sıvı kolloit karışımların ayrılmasında kullanılır. Kirli kanın temizlenmesi.
2. Yoğunluk Farkı İle Ayırma Yöntemleri
Savurma: Yoğunlukları farklı katı karışımların ayrılmasında kullanılır. Buğday ve samanın havaya savrularak ayrılması.
Yüzdürme (Flotasyon): Yoğunlukları farklı iki katının bir sıvı içinde yüzdürülerek ayrılması. Kükürt tozu ve kum karışımı yüzdürme ile ayrılabilir. Genellikle bakır, sülfür, kurşun ve çinko cevherleri yüzdürme yöntemi ile ayrılır.
Aktarma (Dekantasyon): Sıvı içinde dibe çökmüş katıların başka bir kaba aktarma ile ayrılması. Zeytinyağı üretiminde dibe çöken zeytin posalarının aktarma ile ayrılması.
Çöktürme: İki sıvının karıştırılması sonucu çözeltide bulunan iyonların birbirleri ile tepkime verip suda çözünmeyen bir katı oluşturması işlemidir. Bu olaya çökme, oluşan katıya ise çökelek adı verilir.
Santrifüjleme: Süzgeç kâğıdından geçebilecek büyüklükteki katı maddelerin merkezcil kuvvet yardımıyla çöktürülmesi işlemidir. Bu işlem santrifüj denilen aletlerle gerçekleştirilir.
Ayırma Hunisi: Birbiri içinde çözünmeyen yoğunluğu farklı iki sıvının ayrılmasında kullanılır. Zeytinyağı-su karışımı ayırma hunisi kullanılarak ayrılır.
3. Kaynama Noktası Farkı İle Ayırma Yöntemleri
Basit damıtma: Bir karışımdan tek bir sıvının ayrılması basit damıtma olarak adlandırılır. Çeşme suyunun saflaştırılması ile saf su eldesi.
Ayrımsal (Fraksiyonel) damıtma: Sıvı-sıvı homojen karışımların ayrılması işlemidir. Etil alkol-su karışımının ayrılması, petrolün damıtılması bu yolla yapılır.
SORU 1:
KARIŞIM |
BİLEŞENLERİN FİZİKSEL HALİ |
GÖRÜNÜM |
X |
Sıvı-Sıvı |
Homojen |
Y |
Sıvı-Katı |
Heterojen |
Z |
Sıvı-Sıvı |
Heterojen |
Tabloda verilen bilgilere göre X, Y ve Z karışımlarını bileşenlerine ayırmak için kullanılabilecek en uygun yöntemler aşağıdakilerden hangisinde doğru verilmiştir?
X Y Z
SORU 2: Sert sularla ilgili aşağıdakilerden hangisi yanlıştır?
A) Yapılarında çok miktarda Ca+2 ve Mg+2 iyonu bulunur.
B) İyon değiştirici reçineler sayesinde sertlikleri giderilebilir.
C) Sertlik veren iyon değiştirici arttıkça suyun sertliği artar.
D) Endüstride kullanılan buhar kazanlarında kazan taşı oluşumuna sebep olur.
E) Bu sularda sabun daha iyi köpürür ve sabunun temizleme özelliği artar.
SORU 3: Doymamış tuzlu su çözeltisine sabit sıcaklıkta bir miktar su eklenirse;
Yargılardan hangileri doğru olur?
A) Yalnız I
B) Yalnız II
C) I ve II
D) II ve III
E) I , II ve III