KARIŞIMLAR
Karışımların Sınıflandırılması
Birden fazla maddenin kimyasal özellikleri değişmeden bir araya gelmesiyle oluşan sistemlere karışım denir.
Karışımlar homojen ve heterojen olmak üzere iki gruba ayrılır.
1.Homojen Karışımlar (Çözeltiler): Her yerinde aynı özelliği gösteren karışımlara homojen karışım denir. Homojen karışımlar bir maddenin başka bir madde içinde çözünmesi ile oluşur. Bu nedenle homojen karışımlara çözelti denir. Çözeltiler çözücü ve çözünenden oluşur.
Çözücü: Genellikle miktarı fazla olan madde çözücüdür. Su her zaman çözücü sayılır.
Çözünen: Genellikle miktarı az olan madde çözünendir.
Çözünme Şekline Göre Çözelti Çeşitleri Moleküllü Çözelti:
Moleküler Çözelti: Maddenin çözücü içinde molekül halinde homojen dağılması ile oluşan çözeltiler. Kovalent bağlı bileşikler genellikle moleküler çözünme gösterir.
ÖR: C2H5OH, C12H22O11
İyonik Çözelti: Maddenin çözücü içinde iyonlarına ayrışarak homojen dağılmasıdır. İyonik bileşikler iyonik çözünme gösterir.
ÖR: NaCl, Ca(NO3)2...
İyonik çözeltiler elektriği iletir, bunlara elektrolit çözelti denir. Moleküllü çözeltiler ise elektriği iletmez, bunlara elektrolit olmayan çözeltiler denir.
Çözünen Madde Miktarına Göre Çözelti Çeşitleri Doymuş Çözelti: Belirli sıcaklıkta çözebileceği maksimum miktarda maddeyi çözmüş çözeltilerdir.
Doymamış Çözelti: Belirli sıcaklıkta çözebileceği maksimum miktardan daha az çözünen içeren çözeltilerdir.
Aşırı Doymuş Çözelti: Belirli sıcaklıkta çözebileceği maksimum miktardan daha fazla çözünen içeren çözeltilerdir. Aşırı doymuş çözeltiler kararsızdır. Bir dış etki ile çözünen fazla madde çöker.
Çözünen/Çözücü Oranına Göre Çözelti Çeşitleri
Derişik Çözelti: Çözünen miktarı görece fazla olan çözeltilerdir
Seyreltik Çözelti: Çözünen miktarı görece az olan çözeltilerdir.
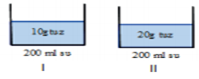
II. çözelti I. çözeltiye göre derişiktir.
I. çözelti II. çözeltiye göre seyreltiktir.
Çözeltiler karıştırıldığında iki çözeltinin arasında bir yoğunlukta yeni karışım elde edilir.
ÇÖZÜNME OLAYI
Hidrasyon ve Solvasyon Bir maddenin suda çözünmesi olayına hidrasyon (hidratasyon), sudan farklı bir çözücüde çözünmesi olayına solvasyon (solvatasyon) adı verilir.
Polarlığın Çözünmedeki Rolü Benzer benzeri çözer ilkesi:
Polar maddeler polar çözücülerde, apolar maddeler apolar çözücülerde iyi çözünür. Bir molekülün polarlığı arttıkça çözünme miktarı artar. İyonik katılar polar çözücülerde iyi çözünür.
CCl4, CH4, C2H6, C6H6, CO2, I2 gibi maddeler apolar moleküllerdir. Bu maddelerin biribiri içinde iyi çözünmesi beklenir.
H2O (su), CHCl3 (kloroform), H2S, HF, C2H5OH (etil alkol), gibi maddeler polar moleküllerdir. Bu maddelerin birbiri içinde iyi çözünmesi beklenir.
NaCl, NaOH, Na2CO3 gibi maddeler iyonik katıdırlar ve polar çözücülerde iyi çözünürler.
CCl4 - H2O, C6H6 - CHCl3 gibi ikili karışımlarda moleküller birbirini iyi çözmez.
Çözünme Olayı ve Kimyasal Değişim,
İyonik katılar, asitler, O2 gazı ve çoğu kovalent bileşik suda fiziksel yolla çözünürken, CO2 gazı ve Na, K gibi aktif metaller suda kimyasal yolla çözünür.
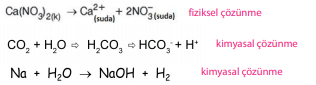
2. Heterojen Karışımlar
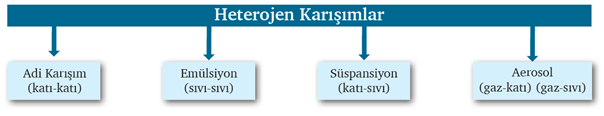
Her yerinde aynı özelliği göstermeyen karışımlara heterojen karışımlar denir.
Adi Karışım: Dağılan ve dağıtıcı faz ayrımı yapılmayan karışımlardır.
ÖR: Karışık çerez, salata gibi.
Süspansiyon (sol):
Bir sıvı içinde, katının tanecik boyutu 1000 nm den büyük olacak şekilde dağılmasıyla oluşan heterojen karışımlardır. Tanecik boyutu 1000 nm ya da daha büyükse kaba süspansiyon, 1000 nm den daha küçükse kolloidal süspansiyon adını alır. ÖR: (Kaba süspansiyon): Çamurlu su, tebeşir tozu ve ayran ÖR: (Kolloidal süspansiyon): Peynir suyu, yumurta akı, kan, yağlı boya
Emülsiyon:
Bir sıvı içinde, başka bir sıvının heterojen dağılmasıyla oluşan heterojen karışımlara emülsiyon adı verilir. ÖR: (Kaba emülsiyon): Su-zeytinyağı, su-karbontetraklorür (CCl4) ÖR: (Kolloidal süspansiyon): Mayonez, süt.
Aerosol: Bir gaz içinde sıvı ya da katının heterojen dağılmasıyla oluşan karışımlara aerosol adı verilir. ÖR: Sis, bulut, tozlu hava, kirli hava, duman, sprey boya, deodorant, sabun köpüğü, süslü camlar, jel, strafor.
Çözelti - kolloid - süspansiyon arasındaki fark:
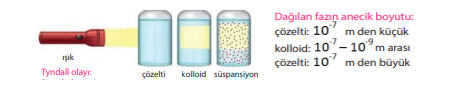
Bir ışık demeti karışımın üzerine gönderildiğinde gözle görülmeyen kolloid taneciklerin ışığı yansıtması sonucu görülmesi olayı. Bu olayla kolloid karışımlar ayırt edilir.