
ÇÖZELTİ OLUŞUMU
Çözeltilerin bir çok türü vardır. En yaygını, çözücünün sıvı, çözünenin ise katı ya da sıvı olduğu sıvı çözeltilerdir.
à çözücü-çözücü etkileşimi à çözünen-çözünen etkileşimi à çözücü-çözünen etkileşimi
Şekillerden de anlaşılacağı gibi pozitif iyon veya dipolün pozitif ucu, su molekülünün negatif ucunu çekerken negatif iyon veya dipolün negatif ucu ise su molekülünün pozitif ucu ile çekilir. Böylelikle iyonik ve polar kristalden tanecikler (iyon, molekül) uzaklaşarak çözeltiye aktarılmış olur. Bu iyon-dipol ve dipol—dipol çekimi oldukça güçlüdür.
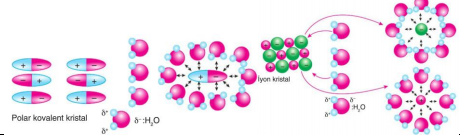

Maddelerin birbiri içinde çözünmesi veya çözünmemesi çözücü ve çözünenin yapısına, çözücü ve çözünenin etkileşimine ve etkileşimin kuvvetine bağlıdır. Yapı olarak birbirine benzer türde veya moleküller arası etkileşim kuvveti birbirine yakın olan maddeler birbiri içinde çok çözünür. Maddelerin birbiri içinde çözünmesi “Benzer, benzeri çözer.ˮ ifadesi ile açıklanabildiği gibi “Polar maddeler polar çözücülerde, apolar maddeler apolar çözücülerde çözünür.ˮ şeklinde de açıklanabilir. Çözeltide çözücü olarak su kullanıldığı zaman çözünen tanecikleri su molekülleri tarafından sarılır. Bu olaya hidratasyon denir. Eğer su yerine başka bir çözücü tercih edilirse hidratasyon yerine solvatasyon kelimesi kullanılır.

Çözelti hazırlarken kullanılacak çözünen ve çözücü miktarları derişimle ilgili hesaplamalarla bulunabilir.

DERİŞİM BİRİMLERİ Çözeltilerde çözünmüş olan bir maddenin miktarının ölçüsü derişim olarak adlandırılır. Derişim yerine konsantrasyon da kullanılabilir. Farklı alanlarda farklı ihtiyaçlar olduğu için birçok derişim birimleri kullanılmaktadır.
1. Molar derişim (molarite)
2. Molal derişim (molalite)
3. Kütlece yüzde derişim
4. Hacimce yüzde derişim
5. Mol kesri
6 . Milyonda bir kısım (ppm)
Molar Derişim (Molarite) Bir çözeltinin 1 litresinde çözünmüş olarak bulunan maddenin mol sayısına o maddenin molar derişimi veya molaritesi adı verilir. • Molar derişim M ile gösterilir. Molaritenin birimi mol. L-1 dir. Bir çözeltinin molaritesi hesaplanırken daima çözeltinin hacmi litre olarak alınır.
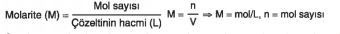
Daha önceden hazırlanmış doygun olmayan bir çözeltiye bir miktar daha madde eklenebilir. Bu da çözeltinin derişimini artırır. Doygun olmayan çözeltiden bir miktar suyun çökelme olmaksızın buharlaştırılması çözeltinin derişimini artırır. Bir çözeltinin derişimini artırmak için yapılan işlemlere deriştirme denir.
Bir çözeltideki maddenin derişimini su ekleyerek çözeltinin hacmini artırma veya maddenin bir kısmını çöktürme gibi işlemlerle küçültülmesine seyreltme denir. Çözünen maddenin miktarını değiştirmeden çözeltinin hacmi değiştirildiğinde, çözünenin mol sayısı değişmeyeceğinden; M1.V1 = M2.V2 olur. Çünkü mol sayısı; n = M.V’dir.
Yoğunlukla Derişim Hesaplama

Çözeltilerde Seyreltme – Deriştirme Yapılırsa Son Derişimi Hesaplama
M1. V1 = Mson. Vtoplam
Aynı Tür Çözeltilerin Farklı Derişimleri Karıştırılırsa Oluşan Çözelti Derişimini Hesaplama
M1. V1+ M2. V2 + ……= Mson. Vtoplam
Farklı Türdeki Çözeltilerde Oluşan İyonların Derişimini Hesaplama


Molal Derişim (Molalite) Bir kilogram çözücü içerisinde çözünmüş olan maddenin mol sayısına molal derişim veya molalite denir.

Kütlece Yüzde Derişim 100 gram çözeltide çözünmüş olan maddenin miktarına kütlece yüzde derişim denir. à% C ile gösterilir.
