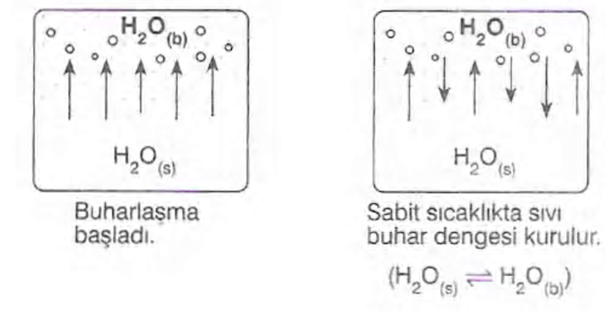
Sıvı - buhar denge basıncı:
1.Sıvının cinsine bağlıdır. Tanecikler arası çekim kuvveti küçük olan sıvıların uçuculukları fazladır. Bu nedenle denge buhar basınçları da büyük olur.
2.Sıvının saflığına bağlıdır. Uçucu olmayan katı maddeler bir sıvı içinde çözünecek olursa tanecikler arasındaki çekim kuvvetleri artacağından uçuculuk azalır. Dolayısıyla denge buhar basıncı azalır.
3.Sıvının sıcaklığına bağlıdır. Sıcaklık arttıkça tanecikler arası çekim kuvveti azalır, denge buhar basınçları artar.
Sıvı - buhar denge basıncı:
Sıvı ısıtıldığında sıcaklığı ve yüzeyindeki buhar basıncı giderek artar. Bir süre sonra sıvının buhar basıncıyla atmosfer basıncı birbirine eşit olur. Bu durumda yeterli kinetik enerjiye sahip sıvı moleküller gaz fazına geçerler. Bu olaya kaynama denir. Bu sıradaki sıcaklığa da kaynama noktası denir.
-Sıvılar her sıcaklıkta buharlaşır ancak kaynama noktasına ulaştığında kaynar. Her saf sıvının kaynama noktası tek bir sıcaklıktır. Dolayısıyla buharlaşma ile kaynama karıştırılmamalıdır.
-Kaynama noktası açık hava basıncına bağlıdır. Açık hava basıncı artarsa kaynama noktası da artar.
-Buharlaşma hızı sıcaklık ve yüzey alanına bağlıdır. Sıcaklık arttıkça ve yüzey alanı büyüdükçe buharlaşma hızı artar.
Bağıl Nem: Dünyadaki su döngüsü, suyun buharlaşması ve yoğunlaşması temeline dayanır. Havanın içeriğinde aslında sürekli olarak su buharı da bulunmaktadır. Bu şekilde ifade edilen hava nemli hava olarak tanımlanır. İçerisinde su buharı içermeyen hava kuru hava olarak tanımlanır. Havadaki su buharının kısmi basıncının, aynı sıcaklıktaki suyun denge buhar basıncına oranı bağıl nem olarak tanımlanır ve yüzde ile verilir. Bağıl nem sıcaklıkla ters orantılıdır.
Bağıl nem = Su buharının kısmi basıncı/Suyun denge buhar basıncı.100
Bağıl nem % 100’ den büyük olduğunda sıcaklık düşükse nem yağış olarak yeryüzüne iner.
Maddenin akışkan hallerinden biri de gaz halidir. Gazlar konusunda maddenin gaz hali incelenir. Gazlar konuldukları kabı doldurmak üzere genişleyen, bastırıldıklarında çok küçük hacimlere kadar sıkıştırılabilen akışkanlardır. Bu konuda; hacim, sıcaklık, mol sayısının değişmesiyle gaz fazındaki taneciklerin davranışları incelenecektir. Gazların Özellikleri
Tüm gazların genleşme katsayıları aynı olup, genleşme katsayısı gazlar için ayırt edici değildir.
Gazları Niteleyen Büyüklükler
Mol sayısı, hacim, sıcaklık ve basınç bir gazı tam olarak niteleyen büyüklüklerdir.
Mol sayısı: Gazın miktarı mol sayısı ile verilir. Kütlesi verilen bir gaz örneğinin mol sayısı hesaplanabilir. Bütün kimyada geçerli olan n = m/MA formülü ile gazlarda mol sayısı elde edilebilir. Bağıntıda n maddelerin mol sayısını, m kütlesini ve MA ise mol kütlesini belirtir. Mol sayısının birimi mol, kütlesinin birimi gram ve mol kütlesinin birimi de g/mol'dür.
Gaz hacmi: Gaz tanecikleri sürekli hareket halinde olduğundan içine konuldukları kabı doldurmak üzere genişlerler. Dolayısıyla bulundukları kabın hacmini ve şeklini alırlar. Gaz hacmi m3, dm3(L), cm3(mL) birimleri ile ifade edilir. 1m3 = 10dm3 = 103L = 106cm3 = 106ml
Sıcaklık: Bir gazın sıcaklığı gaz taneciklerinin ortalama kinetik enerjisi ile doğru orantılıdır. Sıcaklık arttıkça taneciklerin hızı artar. Taneciklerin hızının artması kabın çeperlerine ve birbirlerine yaptıkları çarpma sayısını artırır. Sıcaklık termometre ile ölçülür. Sıcaklık kütleden bağımsızdır. Sıcaklık birimi olarak kimyada en çok kullanılanlar Celcius (°C) ve Kelvin (°K) birimleridir. Gazlarla ilgili tüm eşitliklerde Kelvin (°K) birimi kullanılır. Bu birimler arasında aşağıdaki eşitlik vardır. T(°K) = T(°C) + 273 0°C'ta mutlak sıcaklık 273°K’dir.
Gaz basıncı: Bir gazın molekülleri sabit bir hızda hareket ederken birbirleriyle ve kabın çeperleriyle çarpışırlar. Gaz moleküllerinin kabın çeperlerine çarpması sonucu oluşan kuvvete gaz basıncı denir. Basınç birimi arasında; 1 atm = 76 cmHg =760 mmHg =760 torr ilişkisi vardır. Hava bir gaz karışımıdır ve yeryüzüne ağırlığından dolayı bir basınç uygular. Bu basınca açık hava basıncı ya da atmosfer basıncı denir. Atmosfer basıncı barometre ile ölçülür. Toriçelli deneyi olarak bilinen deneyle atmosfer basıncı ölçülmüştür. Bu deneyde uzun bir deney tüpü cıva ile doldurulup daha sonra cıva dolu bir kap içerisine ters çevrilir. Belli bir süre sonra deney tüpündeki cıvanın bir kısmı kabın içerisine basılır ve deney tüpü belli bir seviyeye kadar cıva ile dolu olur. Açık hava basıncı tüp içerisindeki civanın basıncını dengelemektedir.
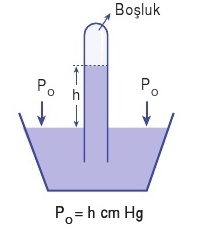
Sıvı olarak civanın kullanılmasının sebebi civanın yoğunluğu büyük olduğu için çok uzun tüp gerektirmemesidir. Kullanılan sıvının yoğunluğu düştükçe tüpteki yükseklik artar.
Manometreler: Kapalı kaplardaki gaz basıncını ölçen aletlere manometre denir.
Barometre : Açık hava basıncını ölçen aletlere barometre denir.
Günlük hayatta, sanayide ve birçok alanda gazların hal değiştirme özelliklerinden faydalanılır. Gazlar daha kolay taşınıp depolanabildiği zaman daha kullanışlı hale gelir. Gazların hal değişimi ile kullanıldığı haller incelenirse;
LPG: Sıvılaştırılmış petrol gazlarıdır. Bileşimi ülkelere göre farklılık gösterir. Türkiye’de %30 Propan %70 bütandır.
LNG: -163 oC ‘ de yoğunlaştırılan sıvı hale geçmiş petrol gazlarıdır. Sıvılaştırılmış hacmi normal hacminden 600 kat daha küçüktür. Hidrokarbonlar karışımıdır.
İtici Gazlar: Gazlar LPG ve LNG’ de olduğu gibi sıvılaştırılabilir. Üzerlerindeki yüksek basınç aniden kaldırıldığında büyük bir hızla gaz fazına geçerek püskürtü oluştururlar. Spreyler deodorantlar v.b. kullanım alanlarıdır.
Soğutucu Akışkan: Ortamdan ısı alarak buharlaşan ve ortamı soğutan maddelere soğutucu akışkan denir. Bir maddenin soğutucu akışkan olabilmesi için o maddenin basınçla sıvılaşabilmesi ve üzerindeki basınç kaldırıldığında genleşerek buhar haline geçebilmesi gerekir. Soğutucu akışkanların kritik sıcaklıkları yüksek kaynama noktaları düşük olmalıdır. NH3 , CH3Cl, C3H8 gibi gazlar örnektir. Belli bir basınç altında buharlaşırken ortamdan ısı alarak ortamın soğumasını sağlayan akışkanlara soğutucu akışkanlar denir. Oda koşullarında gaz halinde bulunan maddeler, soğutucu akışkan olarak kullanılamaz. Soğutucu akışkan olarak kullanılabilmesi için kaynama noktasının oda sıcaklığından çok düşük, kritik sıcaklığının ise çok yüksek olması gerekir. He, Ne, 02, . . . gibi gazlar ve oda koşullarında sıvı olan su soğutucu akışkan olarak kullanılamaz.
Freon-12 (CCI2F2) ve amonyak gibi gazlar soğutucu akışkan olarak kullanılırken Freon-12 gazının ozon tabakasına etkisi ve amonyağın zehirli, patlayıcı bir gaz olmasından dolayı günümüzde kullanımını yitirmiştir.
Soğutucu akışkanlar şu özelliklere sahip olmalıdır:
En çok kullanılan soğutma akışkanları şunlardır: Freon 22, Freon 134a, Freon 407c, Freon 410A (Ozona zararsızdır. ) 407c'nin muadili olup daha verimli olduğundan 407c nin yerini tamamen almıştır.
Kritik sıcaklık: Bir gazın basınçla sıvılaşabileceği en yüksek sıcaklıktır.
Havadan Azot ve Oksijen Eldesi
- Hava homojen bir karışımdır.
- Havanın % 78’ i azot % 21’i oksijen ve % 1’i değişik gazlardan(argon, su buharı, karbondioksit…) oluşur.
- Havadan oksijen ve azot eldesi ayrımsal damıtma damıtma yöntemiyle gerçekleşir.
- Ayrımsal damıtma ile kaynama noktası daha düşük olduğu için önce azot gazı sonra oksijen gazı elde edilir.
4. Maddenin Plazma Hali
Maddenin dördüncü hali olan plazma, gaz halindeki maddelere enerji verildiğinde bazı gaz atomlarında elektron veya elektronlar koparılabilir.
Bir süre sonra ortamda nötr atomlarla birlikte serbest elektron ve iyonlardan oluşan bir karışım bulunur. Bu karışıma plazma (iyonize olmuş gaz) denir.
Bu hale örnek güneş, şimşek, yıldırımlar, floresan lambalar, plazma televizyonlar verilebilir.