MADDENİN HALLERİ
Bu konu başlığı altında maddenin katı, sıvı ve gaz incelenecektir. Maddelerin katı, sıvı ve gaz durumunda gösterdikleri özellikler maddeleri tanımamız açısından önemlidir.
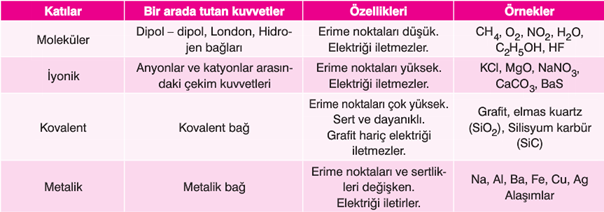
Katıların türü, atom, molekül ya da iyonları bir arada tutan kuvvetlere bağlıdır. Katı maddeler amorf katılar ve kristal katılar olmak üzere ikiye ayrılır.
Amorf Katılar: Atom, iyon ya da moleküllerin rastgele yığıldığı, sert, sıkıştırılamayan ve belirli geometrik kristalleri olmayan katılara amorf katılar denir. Plastikler, cam, tereyağı, lastik gibi katılar amorf katılara örnek olarak gösterilebilir. Amorf katılar ısıtıldıklarında belirli bir sıcaklık aralığında yumuşarlar, yumuşamanın başladığı sıcaklığa camsı geçiş sıcaklığı denir.
Kristal Katılar: Atom iyon ya da moleküllerin düzenli bir şekilde sıralandığı, sert, sıkıştırılamayan ve belirli geometrik şekle sahip kristalleri bulunan katılara kristal katılar denir. Tuz, şeker, elmas, altın, gümüş gibi katılar kristal katılara örnek olarak gösterilebilir. Kristal katılar kristal örgüde yer alan türlere göre şöyle sınıflandırılır:
1.İyonik Kristaller
Yüklü parçacıklardan oluşurlar. Örgü noktalarında + ve - yüklü iyonlar bulunur. Dolayısıyla katıyı bir arada tutan kuvvetler bu iyonlar arasındaki elektrostatik çekme kuvvetidir. İyonik kristallere örnek olarak KCI, CaSO4, ZnS vb. verilebilir.
İyonik kristallerin erime noktaları yüksektir. Katı halde elektriği iletmezler. Ancak suda çözündüklerinde ve eritildiklerinde elektriği iletirler. Kırılgandırlar.
2.Kovalent Kristaller
Örgü noktalarında atomlar bulunur. Kovalent kristaller, katının bütünü içindeki atomlar arasında oluşan kovalent bağ örgüsü ile meydana gelirler. Bu kovalent bağlar, kristal içinde üç boyutlu bir ağ yapısı oluştururlar. Kovalent kristallere örnek olarak elmas, SİC, SİO2 ... vb. verilebilir. Kovalent katılar çok sert olup, yüksek erime noktasına sahiptirler. Elektrik akımını iletmezler.
3.Moleküler Kristaller
Örgü noktasında moleküller ya da atomlar bulunur. Örgü noktalarındaki türler arasında da dipol - dipol, dipol - indüklenmiş dipol, London kuvvetleri, hidrojen bağları gibi bağlar meydana gelir. Moleküler kristallere örnek olarak CO2 (kuru buz), H2O (buz), C12H22O11 (şeker) ... vb. verilebilir. Bu kristaller yumuşaktırlar ve genellikle erime noktaları düşüktür. Elektrik akımı iletmezler.
4.Metalik Kristaller
Her örgü noktasında aynı metalin katyonları bulunur, bu katyonlar belirli bir düzene göre yerleşmiş olup tüm katı boyunca elektron bulutlarıyla çevrilmişlerdir. Örgüdeki bağlar ise + yüklü iyonlar ile serbest elektronlar arasındaki elektrostatik çekme kuvvetlerinden ileri gelir. Metalik katılara örnek olarak Na, Mg, Ag, Au . . . vb. verilebilir. Metalik kristaller, sertten yumuşağa doğru değişen sertliğe düşükten yükseğe doğru değişen erime sıcaklığına sahiptirler. Parlaklıkları, tel ve levha haline gelebilmeleri, ısı ve elektrik iletkenlikleri elektron bulutlarının hareketliliğinden kaynaklanır.
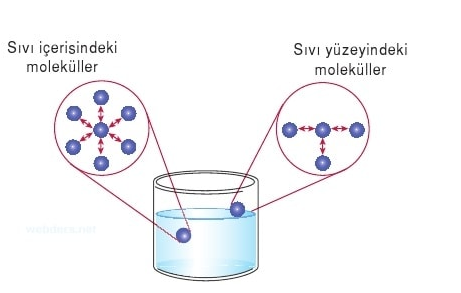
Maddenin üç temel halinden biri de sıvı halidir. Sıvı haldeki tanecikler birbirleri üzerinden kayarak hareket ederler. Sıcaklık arttıkça sıvı moleküllerinin hareketi artar. Sıvı molekülleri titreşim ve öteleme hareketi yaparlar. Bu hareketler sonucunda bulundukları kabın hacmini alırlar. Sıvı molekülleri arasındaki boşluk, gaz molekülleri arasındaki boşluktan az olduğu için birbirleri arasında daha çok çarpışma yaparlar. Bilinen en önemli sıvı sudur.
Viskozite: Sıvıların akmaya karşı gösterdiği direnç viskozite olarak adlandırılır. Viskozitesi büyük olan sıvılar küçük olanlara göre daha yavaş akar. Örneğin balın akıcılığı, suyun akıcılığından daha küçüktür. Çünkü balın viskozitesi suyunkinden büyüktür. Sıcaklık arttıkça sıvıların viskozitesi azalır, akıcılığı artar. Örneğin viskozitesi yüksek olan asfalt yola dökülmeden ısıtılır viskozitesi azaltılarak akışkan hale getirilir. Sıvıların molekülleri arasındaki çekim kuvvetinin büyüklüğü ile viskozite doğru orantılıdır.
Hal Değişimleri: Maddenin üç temel hali vardır. Bunlar katı, sıvı ve gaz halleridir. Maddenin hali sıcaklık ve basınç etkilerine göre değişir.
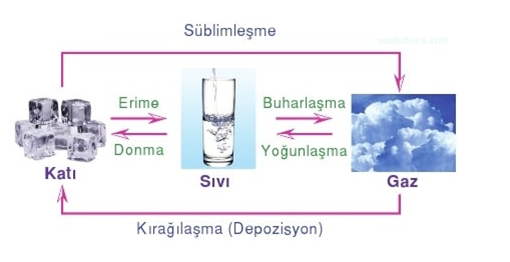
Hal Değişim Olayları
Saf Maddelerin Hal Değişimi
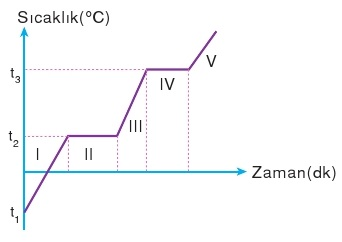
Sıvı Buhar Dengesi ve Kaynama
Sıvı kapalı bir kaba konduğunda zamanla sıvının buharlaşmasından dolayı gaz fazındaki tanecik sayısı artar. Gaz fazındaki bu tanecikler hareketleri sırasında sıvı yüzeyine çarparak sıvı faza geçebilirler. Öyle bir an gelir ki, birim zamanda gaz fazına geçen molekül sayısı ile sıvı faza geçen molekül sayısı birbirine eşit olur. Bu duruma sıvı - buhar dengesi denir. Bu andaki buharların basıncına da buhar basıncı denir.Sıvının buhar basıncının içinde bulunduğu kabın hacmi, şekli ve sıvı miktarı etkilemez.