
Gazların Kinetik Teorisi: Gazların, katılara ve sıvılara göre farklılık gösteren davranışlarını açıklayabilmek için bir teori geliştirilmiştir. Kinetik teori adı verilen bu teori 19. yüzyılın başlarında Ludwig Boltzman (Ludvig Boltzman), James Clerk Maxwell (Ceyms Klark Maksvel) ve diğer bilim insanlarının çalışmaları ile ortaya konulmuştur. Bu teoriye göre;

Graham Difüzyon Kanunu
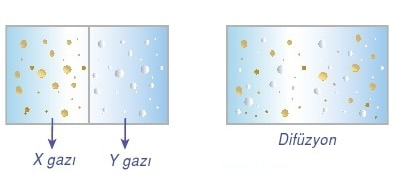
Difüzyon : Gaz taneciklerinin birbiri içinde dağılmasına difüzyon denir.
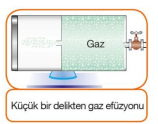
Efüzyon : Bir gazın çok küçük bir delikten sızarak diğer tarafa yayılmasına efüzyon denir. Futbol topunun patladığında havasının inmesi gazların efüzyon olayıyla ilgilidir.
Difüzyon ve efüzyon ikisi de aynı anlama gelmektedir. Aralarındaki fark efüzyonda gaz küçük bir delikten kaçarak yayılır. Difüzyon için kullanılan ifadeler efüzyon için de geçerlidir. Ortalama hız gazın molekül ağırlığına da bağlıdır. V2 α 1/MA Buna göre molekül ağırlığı küçük olan gazın ortalama hızı (difüzyon hızı) büyük olur. Gaz moleküllerinin kolayca karışabilmelerinin sebebi, molekülleri arasında büyük boşluklar olmasıdır. Birbirleri ile tepkime vermeyen A ve B gazları aynı ortamda karıştırıldığında sıcaklık aynı olacağından moleküllerin ortalama kinetik enerjileri de birbirine eşit olur.
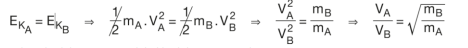
Gazların kütleleri yerine molekül kütlelerini yazarsak eşitliği
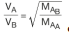
elde edilir. Elde edilen eşitlik gazların yayılma hızlarının mol kütlelerinin karekökü ile ters olduğunu göstermektedir. Bu eşitlik 1828 - 1833 yıllarında yaptığı deneysel çalışmalar sonucunda, Thomas Graham (Tamıs Gıraham) tarafından bulunmuş ve Graham Difüzyon Kanunu adını almıştır. Aynı şartlarda molekül kütlesi yoğunlukla doğru orantılı olduğundan, molekül kütleleri yerine yoğunluklar kullanılarak
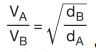
eşitliği elde edilir. Ayrıca, molekül kütlesi küçük olan molekül daha kısa sürede yayılacağından, moleküllerin hızları yayılma süreleri ile ters orantılıdır.
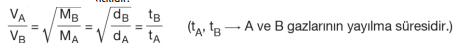
Herhangi bir X gazı için moleküllerinin kinetik enerjisi;

formülü ile ifade edilmektedir. Bu iki kinetik enerji ifadesi eşitlendiğinde
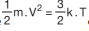
eşitliği elde edilir. Bir gazın sıcaklığıyla hızı arasındaki bağıntı ise (m ve k aynı olduğundan)
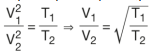
şeklinde bulunur. Örnek verilirse ;
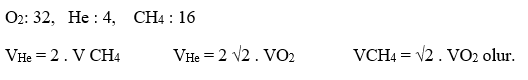
Gazların yayılma hızları, mutlak sıcaklığın karekökü ile doğru orantılıdır. Sıcaklıkları aynı olan gazların ortalama kinetik enerjileri de aynıdır.
Sabit basınçta kapalı bir kaptaki gazın küçük bir delikten, kabın iç basıncı dış basıncına eşit olana kadar, dışarıya doğru yayılmasına efüzyon (dışarı yayılma) denir. Difüzyon ve efüzyon ikisi de aynı anlama gelmektedir. Aralarındaki fark efüzyonda gaz küçük bir delikten kaçarak yayılır. Difüzyon için kullanılan ifadeler efüzyon için de geçerlidir. Ortalama hız gazın molekül ağırlığına da bağlıdır. V2 α 1/MA Buna göre molekül ağırlığı küçük olan gazın ortalama hızı (difüzyon hızı) büyük olur.