GAZLAR
GAZLARIN GENEL ÖZELLİKLERİ
İdeal gazlarda;

Gazlarda Basınç, Hacim, Mol Sayısı ve Sıcaklık İlişkisi Gaz ve gaz karışımlarından oluşan sistemlerin daha iyi anlaşılabilmesi için gazların kimyasal özelliklerinden çok fiziksel özelliklerinin bilinmesi gerekir. Bunlar;
Basınç (P): Birim yüzeye uygulanan kuvvettir. Gaz basıncı birim zamanda birim yüzeye çarpan taneciklerin uyguladıkları kuvvetlerin toplamıdır. Gazın birim zamanda birim yüzeye yaptığı çarpma sayısı ????.√???? /√???????? .???? bağıntısı ile ifade edilir.
Mol sayısı (n): Gazlarda madde miktarı genellikle mol sayısı ile belirtilir. Aynı sıcaklıkta mol sayısı büyük ise, gaz ya çok hacim kaplar ya da yüksek basınç yapar.
Hacim (V): Gazlar içinde bulundukları kabı doldurduklarından dolayı, gazların hacimleri içinde bulundukları kabın hacmine eşittir. Gaz hacmi m3, dm3 ve cm3 birimleri ile verilir.
Sıcaklık (T): Bir maddenin taneciklerinin sahip olduğu ortalama kinetik enerjilerinin bir ölçüsüdür. Termometre ile ölçülür. Birimi Fahrenheit (°F), Reaumur (R), Celcius (°C) ve Kelvin (K) şeklindedir. Gazlarda mutlak sıcaklık ifadesi kullanılırsa Kelvin sıcaklığı demektir. Kelvin sıcaklığı -273°C yani K = 273 + oC demektir. Gazlarla ilgili yapılan tüm hesaplamalarda oC sıcaklığı K sıcaklığına çevrilmelidir. Gaz sözcüğü Yunanca'da karışıklık anlamına gelen kaos sözcüğünden türemiştir. Açık Hava
Basıncının Ölçülmesi
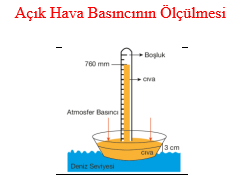
Dünyamız, kalınlığı yaklaşık 10 000 km kadar olan atmosfer dediğimiz bir hava katmanı ile çevrelenmiştir. Bu katman yeryüzüne doğru bir basınç uygular ki bu basınca açık hava basıncı denir. Açık hava basıncını ölçen aletlere de barometre denir. Açık hava basıncı ilk kez 1643 yılında İtalyan Fizikçi Evangelista Torricelli tarafından ölçülmüştür. Basit bir barometre, bir ucu kapalı ve cıva ile doldurulmuş uzun bir cam tüpten ibarettir. Eğer bu tüp, içine hava girmeyecek şekilde bir cıva kabına ters olarak daldırılırsa, tüpteki bir miktar cıva, tüpün yukarısında bir boşluk bırakarak kaba akar. Tüpte kalan cıvanın ağırlığı, kaptaki cıvanın yüzeyine etki eden atmosfer basıncı tarafından dengelenir. Standart atmosfer basıncı (1 atm), deniz seviyesinde ve 0°C de, 760 mm (veya 76 cm) yükseklikte bir cıva sütununun basıncına eşittir. Basıncın SI (uluslararası birim sistemi) ya göre birimi newton / metrekare (N . m–2 ) veya Paskal (Pa) olarak tanımlanır. Diğer basınç birimleri ise bar, atm, mm Hg, Torr'dur.
1 atm = 760 mm Hg= 760 torr
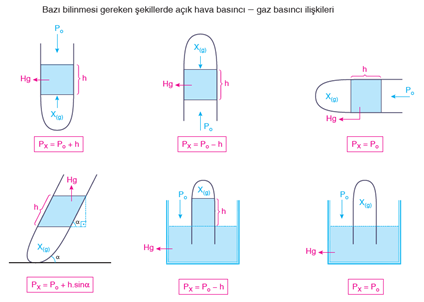
Barometredeki h yüksekliği;
Açık hava basıncı, deniz seviyesinden itibaren yükseldikçe her 10,5 metre için yaklaşık 1 mm (0,1 cm) düşer. Bu düşme yükseklere çıktıkça yavaşlar. Örneğin, Dünya'nın en yüksek tepesi olan Everest'te (8882 m) atmosfer basıncı sıfır olmayıp 250 mm Hg dolayındadır. Bu basınç altında saf su yaklaşık 70°C'de kaynar.
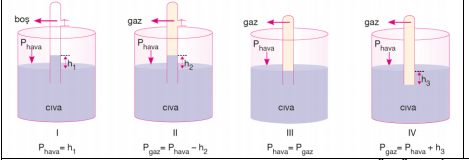
İkinci şekildeki tüpün içinde bulunan gaz, cıvayı aşağıya iterek cıva sütunun yüksekliğinin azalmasına neden olur. Dolayısıyla h2 yüksekliği h1'e göre daha küçüktür.
GAZ BASINCININ ÖLÇÜLMESİ
Kapalı kaplardaki gazların basıncını ölçmede kullanılan aletlere manometre denir. Manometreler U şeklindeki cam borulardır. Manometreler açık uçlu ve kapalı uçlu olmak üzere ikiye ayrılırlar.