ATOM TEORİLERİ
Dalton Atom Modeli
İlk bilimsel atom modelidir.
Bu modele göre atom;

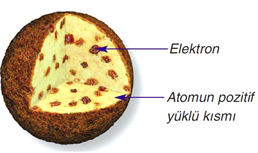
Thomson Atom Modeli
Üzümlü kek modeli olarak bilinir.
Bu modelin en önemli bilinmesi gereken noktası elektronun keşfedilmiş olmasıdır.
Atomun daha küçük parçalar içerdiği bulunmuştur.
Pozitif yüklerin oluşturduğu küre içinde elektronlar dağınık halde bulunur fikri ortaya l-konulmuştur.
Bu kürenin kütlesinin çoğunu pozitif yüklerin oluşturduğu ve atomun yükünün sıfır olduğu fikri öne sürülmüştür.
Rutherford Atom Modeli
Pozitif yüklü protonun keşfi gerçekleşmiştir.
Bu modele göre atom;
Bohr Atom Modeli
Bu modele göre enerji sürekli değil, kesiklidir.
Bohr sürekli olarak enerji kaybeden klasik elektron probleminden kurtulmak için Planck’in kuantumlu enerji düzeyleri düşüncesini yörüngede dolanan elektronlara uyguladı.
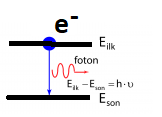
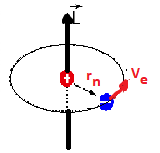
Bir elektron, kararlı yüksek enerjili bir yörüngeden, kararlı düşük enerjili bir yörüngeye geçebilir.
Elektron yörünge geçişinde bir foton yayınlar.

Elektronlar çekirdek çevresinde h/2π tam katları olan açısal momentum değerleri ile dolanırlar.
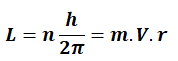
n: yörünge numarası
L: açısal momentum
h: Planck sabiti
m: elektron kütlesi
r: elektronun yörünge yarıçapı
V: elektronun hızı
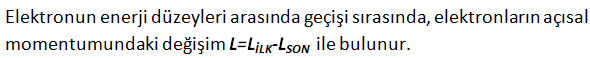
Elektronun enerji düzeyleri arasında geçişi sırasında, elektronların açısal momentumundaki değişim L=LİLK-LSON ile bulunur.
Bohr yörüngelerinde dolanan elektronun çizgisel hızının büyüklüğü yörünge numarası ile ters, atom numarası ile doğru orantılıdır.
Bohr atom modeli ;
Elektronun yörünge yarıçapı
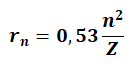
bağıntısı ile hesaplanır.
Z: atom numarası
n:yörünge numarası

Elektronun enerjisi
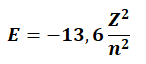
bağıntısı ile n. yörüngede dolanan elektronun enerjisi hesaplanır.
Z: atom numarası
n:yörünge numarası
Yörünge numarası büyüdükçe elektronun enerjisi de artar.
Çekirdek etrafında dolanan elektronun hızından dolayı kinetik, çekirdek etkileşiminden dolayı potansiyel enerjisi bulunur.
Elektronun dışarıdan enerji verilmediği durumda, en küçük enerji düzeyinde bulunur. Bu duruma temel hal ya da taban durumu denir.
Temel haldeki bir atomda, elektronun üst seviyelere çıkması için verilen enerjiye uyarılma enerjisi denir. Uyarılma enerjisi, iki seviye arasındaki enerji farkıyla hesaplanır.
Atomlar ısıtılarak, çarpıştırılarak, elektronlarla, fotonlarla uyarılabilir.
IŞIMA
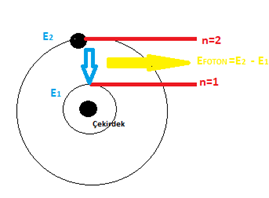
Uyarılan bir elektron çıktığı üst enerji seviyesinde kalamaz. Çok kısa bir sürede daha kararlı olacağı alt enerji seviyesine atlar. Bu olay sırasında fazla enerjisini foton yayınlayarak dışarı verir. Bu olaya ışıma ya da emisyon denir.
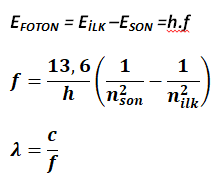
Herhangi bir seviyeye uyarılan elektron, temel hale birkaç farklı yolla inebilir.
Farklı enerjili ışımaların sayısı
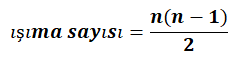
bağıntısı ile hesaplanır.
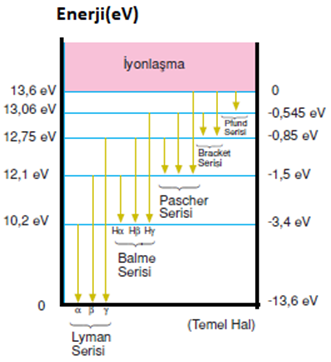
Hidrojen Atomunun Spektrum Serileri
Elektronun değişik dış yörüngelerinden, ayrı yörüngeye geçmesiyle yayılan ışımalar ile oluşur.
Üst yörüngelerden;
n=1 e doğrudan geçişler Lyman Serisi
n=2 e doğrudan geçişler Balmer Serisi
n=3 e doğrudan geçişler Paschen Serisi
De Broglie Elektron Dalgası
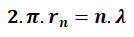
n yörüngede dolanan elektrona eşlik eden Broglie dalga boyu yukarıdaki bağıntı ile bulunur.
rn : yörünge yarıçapı
Modern Atom Teorisi
Klasik fizik anlayışının ötesine geçilmiştir.
Bohr atom modelinden sonra maddenin tanecik ve dalga özelliği birlikte ele alınarak yeni modeller geliştirilmiştir.
Heisenberg Belirsizlik İlkesi
Elektronun yerinin ve momentumunun aynı anda kesin olarak bilinemeyeceğini ileri sürdü.
Elektronun yeri belirlendiğinde momentumu belirsizleşir, momentumu belirlendiğinde yeri belirsizleşir.
Bu durum maddenin doğasından kaynaklanır.
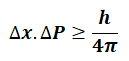
Schrödinger Dalga Denklemi
Elektronların çekirdek etrafında bulunma olasılığının bulunduğu bölegelere elektron bulutu denir.
Schrödinger, dalga fonksiyonunun uzaya ve zamana bağlı denkleminin yazarak bulunma ihtimalinin yüksek olduğu yerleri, enerjileri ve momentumları hakkında hesaplamalara imkân sağladı.
ÖRNEK:
Yukarıda verilen bilgilerden hangileri Thomson atom modeline aittir?
CEVAP: I. , III. ve IV.
ÖRNEK:
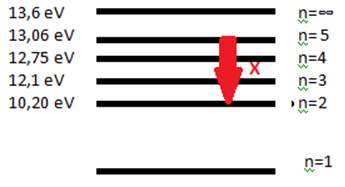
Uyarılmış bir Hidrojen atomu temel hale inerken yukarıda gösterilen X ışımasını yapıyor.
Bu X ışımasının enerjisi kaç eV tur?
CEVAP: