TEPKİME ENTALPİSİNİ (ΔH°) İFADE EDEN BAZI TERİMLER :
1. Yanma Entalpisi (Isısı) :
Standart şartlarda elementlerin ya da bileşiklerin birer mollerinin yakılması sırasındaki entalpi değişimine molar yanma entalpisi denir. Yanma reaksiyonları genellikle ekzotermik olup reaksiyonun gerçekleştiği ortam ısınır. Karbon ve hidrojenden oluşan bileşiklerde yanma ürünleri olarak daima CO2 ve H2O oluşur. Örneğin 1 mol C2H2 gazının yanması sırasında 1300 kj ısı açığa çıkar. Tepkimesi ise
C2H2(g) +5/2O2(g) → 2CO2(g) + H2O(s) ΔH° = –1300 kj şeklindedir. C2H2 gazının molar yanma entalpisi –1300 kj'dür. Benzer şekilde
CO(g) +1/2O2(g) → CO2(g) + 282 kj tepkimesine göre CO gazının molar yanma entalpisi –282 kj iken CO2 gazının molar oluşma entalpisi –282 kj değildir.
2. Nötrleşme Entalpisi (Isısı) :
Asit ile baz çözeltilerinin kimyasal etkileşime uğraması sonucundaki entalpi değişimine nötrleşme entalpisi denir.
HCI(suda) + NaOH(suda) → NaCl(suda) + H2O(s) ΔH° = –56 kj tepkimesine göre HCI ve NaOH’ın molar nötrleşme entalpileri –56 kj’dür.
3. Çözünme Entalpisi (Isısı) :
Bir maddenin bir çözücü içerisinde çözünmesi sırasında iyonlarına ayrılırken veya moleküler olarak bulunurken ortamdan aldığı ya da ortama verdiği ısıya çözünme ısısı denir.
KNO3(k) → K(suda) + NO-3(suda) ΔH° = + 17 kj
LiCl3(k) → Li+(suda) + Cl- (suda) ΔH° = –35 kj
TEPKİME ISILARININ TOPLANABİLİRLİĞİ (HESS YASASI) :
Bir reaksiyonun ΔH° değerinin doğrudan ölçülemediği durumlarda deneysel olarak daha önce ölçülmüş ara basamak reaksiyonlarının entalpi değerlerinden faydalanılır. Tepkime ısılarının toplanabilirliğine dayanan bu yönteme Hess Yasası denir. Hess Yasası’na göre;
TEPKİME ENTALPİLERİNİN BAĞ ENERJİLERİNDEN BULUNMASI
Bir molekülde atomları bir arada tutan çekim kuvvetlerine kimyasal bağ denir. Kimyasal bir tepkimenin gerçekleşmesi sırasında tepkimeye giren maddelerdeki kimyasal bağlar kırılır ve ürünler oluşurken yeni kimyasal bağlar oluşur. Bağ kırılması endotermik, bağın oluşması ekzotermik türden değişimlerdir. Moleküler bir gazın bir molünün atomlarını bir arada tutan bağın standart şartlarda kırılması için gerekli olan enerjiye bağ enerjisi veya bağ kırılma entalpisi adı verilir ve ΔH°B ile gösterilir. Bağ enerjilerinin hesaplanabilmesi için hem ürünlerin hem de reaktiflerin gaz halinde olması gerekir. Standart şartlarda bir bağın kırılması için gereken enerji, aynı bağın oluşumu sırasında açığa çıkan enerji değerine eşittir.
Bağ enerjisi ne kadar büyükse kimyasal bağda o kadar güçlüdür.
Gerçekte iki atom arasındaki bağ farklı moleküllerde farklı değerlerdedir. Örneğin C2H4 bileşiğindeki C–H bağının kırılması için gereken enerji, C2H6 bileşiğindeki C – H bağının kırılması için gereken enerjiden farklıdır. Hatta CH4 bileşiğinde bulunan dört tane C-H bağını ayrı ayrı kopardığımızda harcanan enerji değerleri de farklıdır. Bu nedenle C-H bağının bağ enerjileri hesaplanırken mümkün olduğu kadar çok sayıda bileşikten elde edilen değerlerin bir ortalaması alınır. Bağ enerjileri sadece tek bağ içeren moleküller için değil, ikili veya üçlü bağ içeren moleküller için de hesaplanır (O = O, N ≡ N, –C ≡ N vb). Bağ sayısı arttıkça bağ enerjisi de artar (C ≡ C > C = C > C – C).
Kimyasal bir tepkimede bağların kırılması için gerekli olan enerji toplamından bağ oluşumu sırasında açığa çıkan enerji toplamları çıkarıldığında reaksiyonun standart entalpi değişimi bulunmuş olur. ΔH° = ΣnΔH°B (kırılan bağlar) – ΣnΔH° B (oluşan bağlar)
ENTALPİ DİYAGRAMLARINDAN ΔH° DEĞERİNİN BULUNMASI
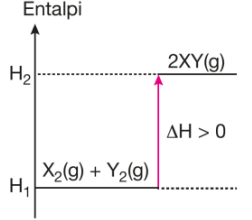
Kimyasal bir tepkimede reaktiflerin ve ürünlerin entalpi değerlerindeki değişim grafiklerle gösterilebilir. Denklemi X2(g) + Y2(g) → 2XY(g) ΔH > O şeklinde olan endotermik bir tepkimede ürünlerin entalpi değerleri reaktiflerinkinden büyüktür. ΔH ise ΔH = H2 – H1 bağıntısı ile bulunur.
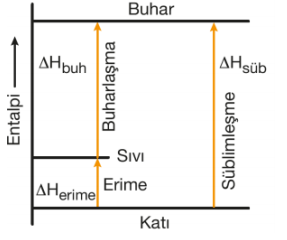
Entalpi bir hâl fonksiyonu olduğundan süblimleşme entalpisi aynı sıcaklıktaki erime entalpisinin ve buharlaşma entalpisinin toplamı olarak ifade edilir.
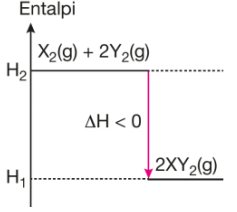
Denklemi X2(g) + 2Y2(g) →2XY2(g) ΔH < O şeklinde olan ekzotermik bir tepkimede girenlerin entalpi değerleri ürünlerinkinden büyüktür. ΔH ise ΔH = H1– H2 bağıntısı ile bulunur.
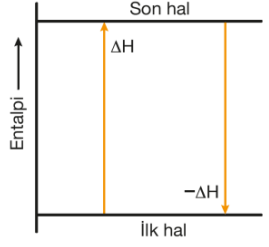
Bir sürecin tersinin entalpi değişiminin değeri, aynı sıcaklıktaki sürecin entalpi değişiminin değeri ile aynı, fakat işareti sürecin entalpisinin işaretinin zıttıdır.