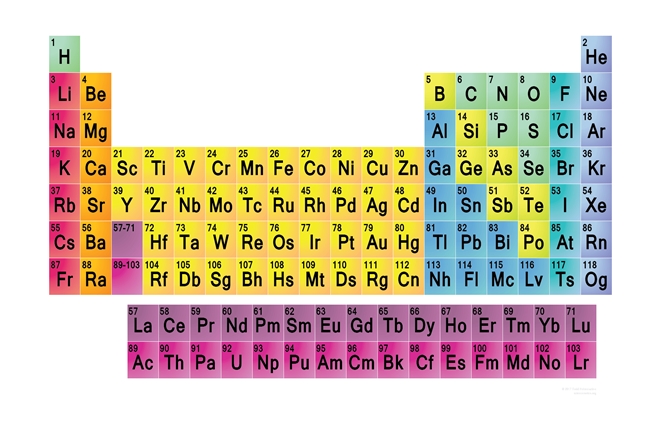

Periyodik Sistem
Antoine-Laurent de Lavoisier 1789 yılında, dünyanın ilk modern kimya kitabı olarak kabul edilen “Kimyanın Bilimsel İncelemesi” adlı kitabı yazdı.
Bu kitapta elementler; metal, ametal ve gaz olarak gruplanmıştı. Bugün bu gruplamayı yanlış olarak bilsek de o günler için yeni keşiflerin önünü açması dolayısıyla çok önemli bir gelişmeydi.
1. TRİADLAR KURALI: İlk sınıflandırma
1. DÖBEREİNER: Elementleri üçerli gruplar halinde sınıflandırmıştır.

Johann Döbereiner (1780 - 1849)
Bu konuyla ilgili ilk çalışmayı 1829 yılında Johann Döbereiner, benzer özellik gösteren elementlerden üçlü oluşturarak gruplar gerçekleştirmiştir.
Ona göre; lityum, sodyum, potasyum benzer özellikler gösterdiği için bir grup oluşturuyordu.
Döbereiner üçlü element gruplarında ortada bulunan elementin atom kütlesi, yoğunluk, en, kn, gibi bazı özelliklerinin diğer iki elementin ortalamasına yakın değerlere sahip olduğunu gösterir.
2. De Chancourtois (Dö Şankortua):
Elementleri ilk kez periyodik olarak tablolama girişiminde bulundu.
Chancourtois Benzer fiziksel özellik gösteren elementleri dikey sıralarda olacak şekilde sarmal olarak sıralamıştır.
Tellür elementini merkeze yerleştirdiği ‘’ tellür spirali” tablosunda elementlerin kütle numaralarına göre grupladı.
16 parçalı bir silindire kütle numaralarına göre spiral şeklinde yerleştirilince dikey olarak sıralanan elementlerin benzer olduğunu ve her 7 elementte bir tekrarladığını keşfetti.
Çok doğru tahminde bulunmasa da periyodik tablonun ilk resmedilmiş hali olduğu kabul edilir.
A.E Beguyer De Chancourtois (Aleksandır Beguyer Dö Şankurtua) (1820 - 1886)
Benzer özellik gösteren bazı element ve iyonları dikey bir sırada gösteren bir tablo oluşturmuştur.

OKTAVLAR KURALI
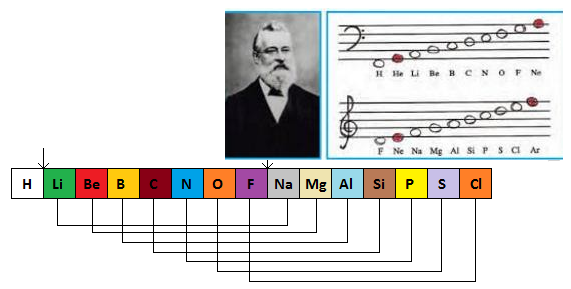
Bilinen 63 elementi fiziksel özelliklerine göre 8 gruba ayırdı ve her sekizinci elementin birbiriyle benzerlik gösterdiğini gördü; müzikal benzerliğinden ötürü bu yasaya “Oktavlar Kuralı” adını verdi.
Aslında Newlands “Oktavlar Kuralı”nı doğru çözümlemişti ama çalışmalarında aralık 8 değil 7 idi.
DİMİTRİ MENDELEYEV: Dimitri Ivanovic Mendeleyev (Dimitri ivanoviç mendelyef) (1834 - 1907) Lothar Meyer (Lotar Meyer) (1830 - 1895) Mendeleyev ve Meyer birbirinden bağımsız,aynı
dönemde elementleri sınıflandırmış ve aynı sıralamayı bulmuşlardır.Ancak Meyer elementleri benzer fiziksel özelliklerine göre sıralarken, Mendeleyev bu sıralamada atom ağırlığını göz önünde bulundurmuştur.
Bugünkü kullandığımız periyodik sisteme en yakın elementler tablosunu DİMİTRİ MENDELYEV yapmıştır.
Mendelyev o dönemde bilinmeyen GALYUM; SKANDİYUM; GERMANYUM elementlerinin özelliklerini tahmin etmiştir.
Örneğin Silisyum elementinin altındaki yeri boş bırakmıştır. Buradaki bulunması gereken elemente Eka- Silisyum adını vermiş ve fiziksel ve kimyasal özellikleri hakkında tahminlerde bulunmuştur.
63 elementten oluşan periyodik çizelgesinde 12 yatay sıra ve 8 dikey sütun kullanmıştır.
Periyodik tablosu ile GRUP kavramını kazandırmıştır.
Elementleri artan atom ağırlıklarına göre yatay sıralamıştır.
Mendeleyev’in tek eksik noktası olarak ise soygazları öngörememesini gösterebiliriz.
NOT: Dimitri mendelyev ve Lothar Meyer aynı zamanda birbirlerinden habersiz birbirine çok benzer elementler tablosu oluşturarak periyodik sistemin ilk en düzenli örneğini oluşturmuştur.
1864 yılında Lothar Meyer, elementlerin değerlik elektron sayısını göz önüne alarak bir periyodik tablo hazırlamıştır. Kütle numarasını yoksaydığından ve ileride keşfedilecek elementleri ön görmemiştir.
Ramsey soygazları keşfederek 8.sütun olarak sisteme eklemiştir.
Glenn Seaborg periyodik sistemin en altında yer alan iki sıra halindeki yapay elementlerin bir kısmını keşfederek periyodik sisteme son şeklini vermiştir.
HENRY MOSELEY: Moseley X ışınları deneyi ile elementlerin kimyasal özelliklerinin atomlarındaki proton sayısına (atom numarasına) bağlı olduğunu ortaya koydu.
1913 yılında Henry Moseley, Mendeleyev’in bir şekilde çözdüğü ama nedenini anlayamadığı tellür-iyot problemine ışık tuttu.
Bu sistem büyük ölçüde doğru sonuç verse de bazen yanılabiliyordu.
Moseley, X-ışını tabancasıyla bu iki elementin atom numaralarını belirledi ve bu sistemin doğruluğu ispatlandı.

PERİYOT
1. Periyot: 2 element 4. ve 5. periyotta: 18 element
2. ve 3. Periyotta: 8 element 6. ve 7. periyotta: 32 element
GRUP
1A alkali metal 4A Karbon Grubu 7A Halojen
2A Toprak Alkali metal 5A Azot Grubu 8A Soygazlar
3A Toprak metal 6A Kalkojen
ELEKTRONİK KATMAN DİZİLİMİ
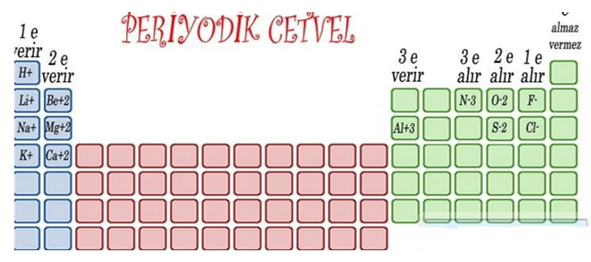
DUBLET KURALI: Atomların tek son katmanlarındaki elektron deizilimlerini He soygazına benzeterek 2 yapmalarına denir.
OKTED KURALI: Son katmanlarındaki elektron sayısını 8 e tamamlayarak He dışındaki diğer soygazlara benzetmeleridir.
A grubu elementleri için;
20Ca:
35Br:
ATOM VE PERİYODİK SİSTEM
Elementlerin periyodik sistemdeki yerlerine göre sınıflandırılması
METALLER
Aktif Metaller Kullanım Alanları
LİTYUM |
Li |
Batarya-pil |
SODYUM |
Na |
Hava yastığı,sofra tuzu,sabun |
POTASYUM |
K |
Gübre,sabun |
KALSİYUM |
Ca |
Alçı,tebeşir,çimento |
Yarısoy Metaller Kullanım Alanları
Bakır |
Cu |
Tel,kablo,metal para,boru |
Cıva |
Hg |
Barometre,dişçilik |
Gümüş |
Ag |
Ayna,pil,çatal,kaşık,bıçak,mücevher |
Soy Metaller Kullanım Alanları
Altın |
Au |
Mücevher, diş kaplaması |
Platin |
Pt |
Diş Kaplaması |
AMETALLER
Ametal |
Sembolü |
Kullanım alanları |
Hidrojen |
H |
Füze yakıtı,balon şişirme,su |
Karbon |
C |
Elmas,kurşun kalem,doğal gaz |
Azot |
N |
Soğutucu sıvı,füze yakıtı,gübre |
Oksijen |
O |
Solunum,yanma,su arıtımı, |
Flor |
F |
Diş macunu katkısı,teflon |
Fosfor |
P |
Havai fişek,kibrit,deterjan,gübre |
Kükürt |
S |
Havai Fişek,meyveleri sarartma |
Klor |
Cl |
Su dezenfeksiyonu,çamaşır suyu |
YARI METALLER
Metallerin ve ametallerin özelliklerini taşır.
Yarı Metal |
Sembolü |
Bazı Kullanım alanları |
Bor |
B |
Füze yakıtı, ısıya dayanıklı cam |
Silisyum |
Si |
Silikon,macun,cam |
Germanyum |
Ge |
Güneş hücreleri,dişçilik |
Arsenik |
As |
Lazer yazıcı,ilaç |
Antimon |
Sb |
Kaynak,kurşun akü |
SOYGAZLAR
Soygaz |
|
Kullanım Alanları |
Helyum |
He |
Meteororlojik balonların dodldurulmasında |
Neon |
Ne |
Televizyon tüplerinde ve lazerde |
Argon |
Ar |
Floresan lambalarında ve ampullerde |
Kripton |
Kr |
Floresan tüplerinde |
Ksenon |
Xe |
Fotoğrafçılıkta,flaş ampullerinde,beyaz ışık elde edilmesinde |
Radon |
Rn |
Radyoaktif özelliği sayesinde kanserli hücrelerin tedavisinde |