NÖTRALLEŞME TEPKİMELERİ
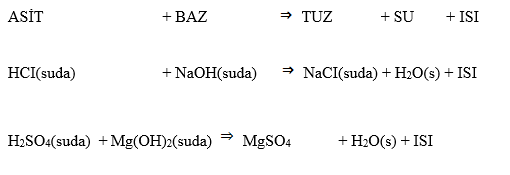
Nötrleşme tepkimelerinde mutlaka su açığa çıkmalıdır
NH3 + HCI --------> NH4CI (asit-baz tepkimesidir) Nötralleşme tepkimesi değildir.
Nötrleşme tepkimeleri aynı zamanda ekzotermik tepkimelerdir
Nötrleşme tepkimelerinde NET İYON DENKLEMİ H2O’ya göre yazılır.
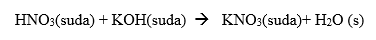
Net iyon denklemi; H+ (suda) + OH-(suda) ---------> H2O(s)
KİMYASAL HESAPLAMALAR :
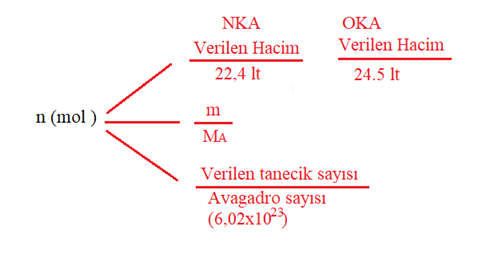
Hesaplamalarda dikkat edilecekler şunlardır: • Hesaplama yapmak için tepkime denkleminin doğru yazılması ve denkleştirilmesi gerekir. • Denkleştirme sırasında maddelerin başına yazılan katsayılar, maddelerin mol sayısını verir. • Tepkimeye giren maddeler ve oluşan ürünler arasında miktar olarak bağlantı kurulurken mol sayılarından faydalanılır. • Tepkime denklemi; mol, tanecik, hacim ve kütle açısından yorumlanarak madde miktarları arasında bağlantı kurulur ve hesaplamalar kolayca yapılabilir. Kimyasal hesaplamalarda madde miktarını mol, tane, litre, gram gibi farklı birimlere çevirmek için aşağıdaki formüller kullanılır.

a) Sınırlayıcı Bileşen Tepkimeleri :
Artan maddesi olan tepkimeler giren maddelerden birisi bitinceye kadar devam eder. Tepkimede tamamen biten maddeye sınırlayıcı bileşen denir. Sınırlayıcı bileşen tepkimeye giren diğer maddelerden önce tükendiği için tepkimenin ve ürün oluşumunun durmasına neden olur.
Örnek : 4 mol N2 ve 6 mol H2 ile başlatılan tepkime tam verimle gerçekleşmektedir. Sınırlayıcı bileşeni bulunuz.
Tam verimle gerçekleşen tepkimede reaktiflerden en az biri tükenmelidir.

b) Yüzde Verim Hesapları :
Kimyasal hesaplama yöntemleri ile tepkimelerde kullanılan madde miktarlarına göre ne kadar ürün elde edilebileceği hesaplanabilir. Elde edilen ürün miktarı hesaplanan ürün miktarı kadarsa bu tip tepkimeye tam verimli tepkime denir. Artanı olan tepkimelerde maddelerden biri tepkime ortamın- da gereken miktardan fazla olabilir. Bu durumda kimyasal tepkimeye giren maddelerden birinin artması, en az birinin de tamamen tükenme- si gerekir. Sınırlayıcı madde bittiği için bir maddenin artması tepkime verimi ile karıştırılmamalıdır.
Teorik (kuramsal) verim: Kimyasal tepkimede denkleştirilmiş tepkimeye göre hesaplanan, sınırlayıcı bileşenin tamamen kullanılmasıyla oluşabilen ürün miktarıdır. Teorik verim bir tepkimede elde edilebilecek en yüksek verimdir.
Gerçek verim: Gerçekleşen tepkime sonunda oluşan ürün miktarıdır. Uygulamada gerçek verim kullanılır. Tepkime sonunda ölçülerek bulunan gerçek verim çoğunlukla teorik verimden düşüktür. Bir tepkimenin yüzde verimi gerçek verimin teorik verime oranı ile hesaplanır ve aşağıdaki formül kullanılır.


c) Mol Kütlesi Hesaplama Soruları:
Kimyasal tepkimede bir elementin atom kütlesi veya bir bileşiğin molekül kütlesi sorulabilir. Denkleşmiş tepkimedeki katsayılardan (mol sayıları) faydalanılarak sorulan maddenin 1 molünün kütlesi bulunur.
Örnek : X(k) + 2 HBr -----> XBr2 + H2
8 gram X yeterince HBr ile tepkimeye girdiğinde NKA’ da 0,2 mol H2 gazı açığa çıkıyor. X elementinin atom kütlesini hesaplayınız.
Tepkimenin altına problemde verilen madde miktarları yazılır.
Tepkimenin üst kısmına tepkimedeki miktarlar aynı birim cinsinden yazılır.
Soruda verilen miktarlardan faydalanılarak tepkimedeki miktarlar bulunur. Tepkimede 1 mol yani mol kütlesi kadar X metali kullanıldığında 1 mol H2 gazı oluşur.

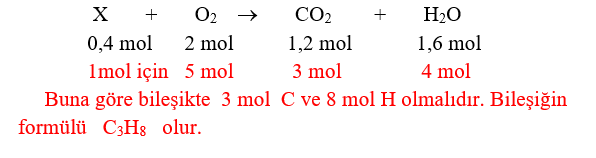
d) Molekül Formülü Bulma Soruları :
Sorularda maddenin 1 molünün tepkimesinden oluşan maddeler belirlenir. Tepkime denkliğinden yararlanılarak formül bulunur.
n x En basit formül = Molekül formül (n=tam sayı) veya
n x En basit formül kütlesi = Molekül formül kütlesi
Örnek : Bir organik bileşiğin 0,4 molü 2 mol oksijenle yandığında 1,2 mol CO2 ve 1,6 mol H2O elde ediliyor. Bileşiğin formülünü bulunuz.
FİZİKSEL DEĞİŞİM
Beş duyu organımızla algıladığımız fiziksel özelliklerdeki (yoğunluk, renk, çözünürlük, iletkenlik, sertlik, erime ve kaynama nok.) değişmelerdir.
KİMYASAL DEĞİŞİM
kimyasal özelliklerdeki (yanıcılık, aktiflik, asallık, asitlik) değişimlerdir. Maddenin iç yapısında gerçekleşir. Geri dönüşüm yoktur.