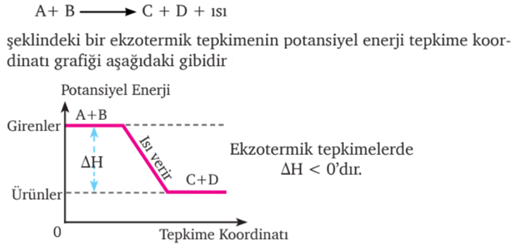
Her maddenin yapısında depoladığı bir enerjisi vardır. Bir sistemdeki taneciklerin titreşim, öteleme, dönme vb. hareketleri nedeniyle oluşan kinetik enerjileri ve birbirleriyle etkileşiminden doğan potansiyel enerjileri maddenin toplam enerjisini oluşturur. Sistemin sahip olduğu bu toplam enerji ısı kapsamı, potansiyel enerji, tepkime ısısı veya entalpi olarak tanımlanır, H harfi ile gösterilir. Sabit basınç altında gerçekleşen bir tepkimede alınan ya da verilen ısı miktarına entalpi adı verilir.
Burada entalpi “H” Entalpi de iç enerji gibi sistem için bir hal fonksiyonudur. Sabit basınçta sistemin aldığı ya da verdiği ısı entalpi değişimine (ΔH) eşittir. Bu sisteme dışarıdan enerji verildiğinde yani ΔH > 0, sistemden ısı şeklinde enerji kaybı olursa yani ΔH < 0 olur. Bir kimyasal reaksiyondaki entalpi değişimi reaksiyon entalpisi (ΔH) olarak tanımlanır. Reaksiyonda oluşan ürünlerin entalpileri ile reaksiyona girenlerin entalpileri arasındaki farka eşittir. Bu durum ΔH = H (ürünler) – H (girenler) şeklinde gösterilir.

Reaksiyon Entalpisinin (ΔH) Değerini Etkileyen Faktörler Sıcaklık ve basınç koşullarına bağlıdır. Entalpi değeri 25°C ve 1 atmosfer basınç koşullarında hesaplandığından bu koşullar değiştiğinde ΔH değeri değişir. Maddelerin fiziksel halleri değiştiğinde tepkimenin ΔH değerleri değişir.

Maddelerin farklı fiziksel hallerinin entalpileri arasında Hgaz > Hsıvı > Hkatı ilişkisinin var olduğunu bilmek tepkime entalpilerini karşılaştırmada kolaylık sağlayacaktır. Madde miktarı değiştiğinde tepkimenin ΔH° değeri değişir. Bir tepkimede mol sayısı ile ΔH° değeri doğru orantılıdır.


Bir kimyasal reaksiyonda tepkimeye giren maddelerin entalpileri toplamı, ürünlerin entalpileri toplamından küçük olduğu durumdur. Endotermik bir dönüşüm gerçekleşme süreci boyunca dışarıdan ısı almaya devam eder. Dolayısıyla endotermik reaksiyonlar kendiliğinden gerçekleşmez ve reaksiyon entalpisinin (ΔH) işareti “+” dır.
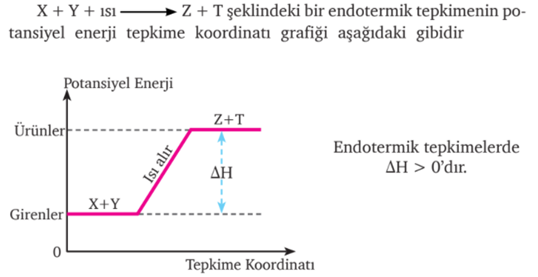



Bir kimyasal reaksiyonda ürünlerin entalpileri toplamının girenlerin entalpileri toplamından küçük olduğu durumdur.