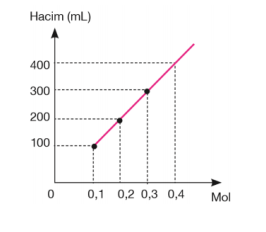
Mol Sayısı–Hacim İlişkisi → Avogadro Kanunu:
Miktarı artırılan bir gazın basıncı ve sıcaklığı sabit ise hacminde bir artış olur. Yani hacimdeki değişim miktarı, molekül sayısındaki değişim ile doğru orantılıdır. Bu oran V a n veya V= k.n (k= sabit) şeklinde ifade edilebilir. Bir gazın iki farklı hacim ve miktarı arasındaki ilişki ise; V1 / n1 = V2 / n2 şeklinde ifade edilir. Deneyler Normal Koşullarda, NK’da (0°C ve 1 atm basınçta) 1 mol (6,02.1023 tanecik) ideal gazın 22,4 litre hacim kapladığını göstermiştir.
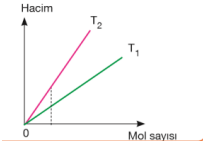
Hacim–mol sayısı grafiğindeki doğruların eğimlerinin karşılaştırılması; Basınç sabitse eğim mutlak sıcaklıklar arasındaki ilişkiyi verir. Eğimi büyük olanın mutlak sıcaklığı büyüktür. T2 > T1
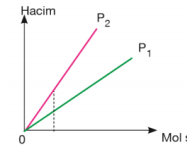
Mutlak sıcaklık sabitse eğim basınçlar arasındaki ilişkiyi verir. Eğimi büyük olanın basıncı küçüktür. P1 > P2
Mol Sayısı – Basınç İlişkisi
Sabit sıcaklık ve hacimde basınç ile mol sayısı doğru orantılı olarak değişir. Sabit hacimli kapta sabit sıcaklıkta mol sayısı arttıkça basınç da artar. Mol sayısı azaldıkça basınç da azalır. Bu oran P ∝ n veya P= k. n (k= sabit) şeklinde ifade edilebilir. Bir gazın iki farklı basınç ve miktarı arasındaki ilişki ise; P1 / n1 = P2 / n2 şeklinde ifade edilir.
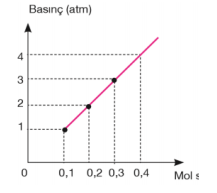
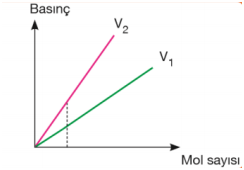
Basınç–mol sayısı grafiğindeki doğruların eğimlerinin karşılaştırılması; Sıcaklık sabitse eğim hacimler arasındaki ilişkiyi verir. Eğimi büyük olanın hacmi daha küçüktür. V1 > V2
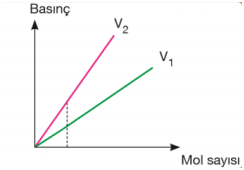
Hacim sabitse eğim mutlak sıcaklıklar arasındaki ilişkiyi verir. Eğimi büyük olanın sıcaklığı daha fazladır. T2 > T1
İDEAL GAZ ve GERÇEK GAZ
Tanecikleri arasında etkileşimin olmadığı varsayılan ve taneciklerinin hacmi gazın kapladığı hacim yanında sıfır kabul edilen gazlar ideal gazlardır. Gerçekte ideal gaz yoktur. Ancak gerçek gazlar ideal hale yaklaşabilirler.
İdeal Gaz Denklemi:
Basit gaz yasalarının üçü hacim değişikliklerine, diğer iki etkenin sabit kaldığı durumda, bir değişkenin etkisini anlatır. Boyle Mariotte kanunundan V ∝ 1/P ilişkisi, Charles kanunundan V ∝ T ilişkisi, Avogadro yasasından V ∝ n ilişkisi anlaşılmaktadır.
Buna göre V ∝ n.T/P yazılabilir. R ile gösterilen ve ideal gaz sabiti olarak adlandırılan orantı kat sayısı kullanılarak P.V = n.R.T eşitliği elde edilir. Bu eşitliğe ideal gaz denklemi denir. İdeal gaz sabiti (R) = 22,4/273 veya 0,082 atm.L/mol.K dir.